
| 放电 |
| 充电 |
| 0.1mol |
| 2 |


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
| A、用SO2漂白纸浆和草帽辫 |
| B、次氯酸钠溶液可用于环境的消毒杀菌 |
| C、用Na2S作沉淀剂除去废水中Cu2+和Hg2+ |
| D、从海水提取物质都必须通过化学反应才能实现 |
查看答案和解析>>
科目:高中化学 来源: 题型:
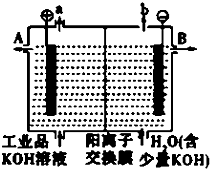 锌银电池能量大、电压平稳,广泛用于电子手表、照相机、计算器和其他微型电子仪器.电解质溶液是KOH溶液,电池总反应为Zn+Ag2O═ZnO+2Ag.请回答下列问题:
锌银电池能量大、电压平稳,广泛用于电子手表、照相机、计算器和其他微型电子仪器.电解质溶液是KOH溶液,电池总反应为Zn+Ag2O═ZnO+2Ag.请回答下列问题:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 ═
═ .
.查看答案和解析>>
科目:高中化学 来源: 题型:
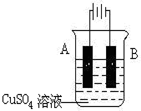 如图电解2L2.5mol?L-1硫酸铜水溶液,如有0.2mol电子转移.
如图电解2L2.5mol?L-1硫酸铜水溶液,如有0.2mol电子转移.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③⑧ | B、②⑧ | C、②⑦ | D、⑤⑨ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com