
 | ⅠA | ⅡA | ⅢA | ⅠVA | VA | VⅠA | VⅡA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ |
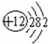 ,⑧
,⑧ ;
;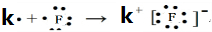 .最不活泼的元素是Ar.(以上均填元素名称)
.最不活泼的元素是Ar.(以上均填元素名称)分析 由元素在周期表中的位置可知,①为N,②为F,③为Na,④为Mg,⑤为Al,⑥为Si,⑦为S,⑧为Cl,⑨为Ar,⑩为K,然后利用同周期从左向右元素的金属性减弱,非金属性增强,同主族从上到下元素的金属性增强,非金属性减弱,且非金属性越强,元素的最高价氧化物对应水化物的酸性越强;金属性越强,元素的最高价氧化物对应水化物的碱性越强.
解答 解:由元素在周期表中的位置可知,①为N,②为F,③为Na,④为Mg,⑤为Al,⑥为Si,⑦为S,⑧为Cl,⑨为Ar,⑩为K,
(1)根据元素周期表的结构可知:①、⑥、⑦分别为N、Si、S,故答案为:N;Si;S;
(2)根据元素周期表可判断,④为Mg,⑧为Cl,Mg和Cl的原子结构示意图分别为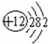 、
、 ,故答案为:
,故答案为: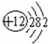 ;
; ;
;
(3)根据元素周期律,从左向右元素的金属性减弱,非金属性增强,同主族从上到下元素的金属性增强,非金属性减弱,惰性气体最不活泼,所以金属性最强的元素是 K,非金属性最强的元素是F,用电子式表示它们形成化合物的过程为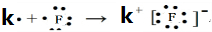 ,最不活泼的元素是Ar,
,最不活泼的元素是Ar,
故答案为:K;F;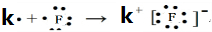 ;Ar;
;Ar;
(4)金属性越强,元素的最高价氧化物对应水化物的碱性越强,钾的金属性强于钠,所以元素③、⑩的氢氧化物碱性由强到弱的顺序是KOH>NaOH,元素非金属性越强,氢化物越稳定,所以元素⑥、⑦、⑧的氢化物稳定性由弱到强的顺序SiH4<H2S<HCl,
故答案为:KOH>NaOH;SiH4<H2S<HCl;
(5)周期中有一种元素,其最高价氧化物的水化物与同周期其它元素最高价氧化物的水化物所属物质类型都不同,则该物质为Al(OH)3,用离子方程式表示该水化物分别与烧碱溶液和稀硫酸的反应为Al(OH)3+OH-=AlO2-+2H2O、Al(OH)3+3H+=Al3++3H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O、Al(OH)3+3H+=Al3++3H2O;
(6)与①和⑥都相邻的一种元素A,它有多种不同形态的单质,其中一种常用作原电池的电极,则A为碳元素,它与⑦的最高价氧化物的水化物浓溶液即浓硫酸在加热时能反应,反应的化学反应方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(7)非金属性越强,元素的最高价氧化物对应水化物的酸性越强,所以通过硫酸的酸性强于碳酸能验证硫的非金属性强于碳,相关反应为稀硫酸能与碳酸盐反应生成二氧化碳和水,反应的离子方程式为CO32-+2H+=CO2↑+H2O,故答案为:CO32-+2H+=CO2↑+H2O.
点评 本题考查元素周期表和元素周期律,熟悉元素在周期表中的位置是解答本题的关键,并利用元素周期律来解答即可,难度不大.


 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向溶液中加入适量氯化铵固体 | |
| B. | 向溶液中加入一定体积的pH=4的盐酸 | |
| C. | 向溶液中加水至溶液体积为1000mL | |
| D. | 向溶液中加入适量醋酸钠固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.05mol | B. | 0.075mol | C. | 0.15mol | D. | 0.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;写出它与原子半径最小的原子形成10电子且为正四面体结构的化合物的电子式
;写出它与原子半径最小的原子形成10电子且为正四面体结构的化合物的电子式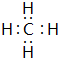 ,用电子式表示⑤和⑧形成化合物的过程
,用电子式表示⑤和⑧形成化合物的过程 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2y-x) kJ•mol-1 | |
| B. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(4x-y) kJ•mol-1 | |
| C. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2x-y) kJ•mol-1 | |
| D. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(8x-2y) kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 分类标准 | 氧化物 | 电解质 | |||
| 属于该类的物质 | ② | ⑧⑨ | ⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com