
科目:高中化学 来源: 题型:
| ||
. |
| 1 |
| 6 |
| 1 |
| 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:

图6-4
(1)若用图6-4中所列仪器和导管组装实验装置,如果所制气体流向从左到右时,仪器和导管连接的顺序是________接________接________接________接________接________。(填编号)
(2)仪器连接好后进行实验时有下列操作:①在仪器C中装入
(3)这样制得的H2中含有什么气体杂质?应该怎样除去?
(4)若实验时消耗2.9 mL无水乙醇(密度为
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省德州市高三1月月考化学试卷(解析版) 题型:填空题
(15分)能源的开发、利用与人类社会的可持续发展息息相关,怎样充分利用好能源是摆在人类面前的重大课题。
I.已知:Fe2O3(s)+3C(石墨) =2Fe(s)+3CO(g) △H=akJ·mol-1
CO(g)+1/2O2(g)= CO2(g) △H=bkJ·mol-1
C(石墨)+O2(g)=CO2(g) △H=ckJ·mol-1
则反应:4Fe(s)+3O2(g)= 2Fe2O3(s)的焓变△H= kJ·mol-1。
Ⅱ.(1)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是 (填序号)。
A.C(s)+CO2(g)=2CO(g)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)
C.2H2O(l)= 2H2(g)+O2(g)
D.CH4(g)+2O2(g)=CO2(g)+2H2O(l)
若以KOH溶液为电解质溶液,依据所选反应可以设计成一个原电池,请写出该原电池的电极反应。
负极: ,
正极: 。
(2)二氧化氯(ClO2)是一种高效安全的自来水消毒剂。ClO2是一种黄绿色气体,易溶于水。实验室以NH4Cl、盐酸、NaClO2为原料制备ClO2流程如下:
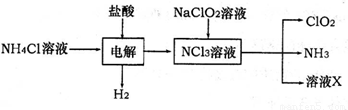
已知:电解过程中发生的反应为:
NH4Cl+2HCl NCl3+3H2↑;假设NCl3中氮元素为+3价。
NCl3+3H2↑;假设NCl3中氮元素为+3价。
①写出电解时阴极的电极反应式 。
②在阳极上放电的物质(或离子)是 。
③除去ClO2中的NH3可选用的试剂是 (填序号)
A.生石灰 B.碱石灰 C.浓H2SO4 D.水
④在生产过程中,每生成1mol ClO2,需消耗 mol NCl3。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省淄博潍坊市高三(上)期末化学试卷(解析版) 题型:填空题

 NCl3+3H2↑;假设NCl3中氮元素为+3价.
NCl3+3H2↑;假设NCl3中氮元素为+3价.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com