
| A、甲:物质中的粒子数; 乙:阿伏加德罗常数 |
| B、甲:标准状况下的气体摩尔体积; 乙:标准状况下的气体的体积 |
| C、甲:固体的体积; 乙:固体的密度 |
| D、甲:溶液中溶质的物质的量浓度; 乙:溶液体积 |
| N |
| NA |
| V |
| Vm |
| N |
| NA |


科目:高中化学 来源: 题型:
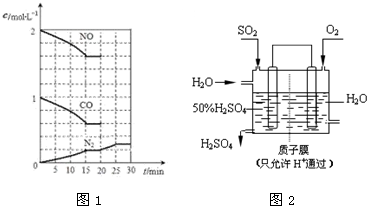
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol Na2O2与足量CO2充分反应转移的电子数为2NA |
| B、常温下,pH=1的醋酸溶液中,醋酸分子的数目一定大于0.1NA |
| C、向FeI2溶液中通入适量氯气,当有1molFe2+被氧化时,总共转移电子的数目为NA |
| D、t℃时,1L pH=6的纯水中,含1×10-6 NA个OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
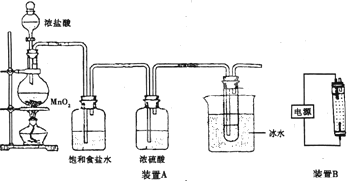
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、太阳能、地热能、核能等均属于新能源 |
| B、“低碳”是指采用含碳量低的烃类化合物作燃料 |
C、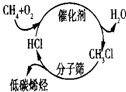 甲烷经一氯甲烷转化成低碳烯烃的途径体现了“节能减排”思想 |
| D、减少化石能源的使用能减少CO2的排放量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、H2O2的电子式: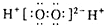 |
| B、结构简式(CH3)2CHOH可以表示1-丙醇,也可以表示2-丙醇 |
| C、二氧化硅的分子式:SiO2 |
| D、质子数为8,中子数为10的氧原子:818O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、6.0g/mol |
| B、5.0g/mol |
| C、10.0g/mol |
| D、4.0g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 开始沉淀 | 完全沉淀 |
| Fe(OH)3 | 2.7 | 3.7 |
| Al(OH)3 | 3.7 | 4.7 |
| Cr(OH)3 | 4.6 | 5.6 |
| Zn(OH)2 | 6.0 | 8.0 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 反应 温度/℃ | c(HCl)/ mol?L-1 | V(HCl) /mL | 10g碳酸钙的形状 | t/min |
| 1 | 20 | 2 | 10 | 块状 | t1 |
| 2 | 20 | 2 | 10 | 粉末 | t2 |
| 3 | 20 | 4 | 10 | 粉末 | t3 |
| 4 | 40 | 2 | 10 | 粉末 | t4 |
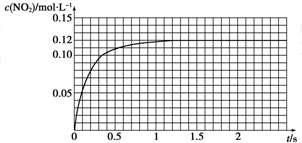
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com