
(10分)A、B、C、 D四种溶液分别是NaOH溶液、氨水、 CH3COOH溶液 、盐酸中的一种。常温下:
①浓度均为0.1mol·L-1的A和C溶液,pH:A<C<7;
②将1 L pH=3的A溶液分别与0.001mol·L-1 xL B溶液、0.001mol·L-1 yL D溶液充分反应至中性,x、y大小关系为: y<x;
回答下列问题:
(1)D是 (填化学式)溶液;
(2)②中1LpH=3的A溶液与0.001mol·L-1 xL B溶液充分反应至中性,所得溶液中各种离子的物质的量浓度由大到小的顺序为 。
(3)常温下,等体积且等物质的量浓度的C溶液和 D溶液充分混合后所得溶液的pH
7(填“>”、“<”或“=”),用离子方程式解释其原因 。
(4)向pH相同且等体积的两份溶液A和C中,分别投入质量不同的锌粉反应,若放出氢气的质量相同,则下列说法正确的是 (填写序号)。
①开始反应时的速率A>C ②反应所需要的时间C>A
③参加反应的锌粉物质的量A=C ④A溶液里有锌粉剩余
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
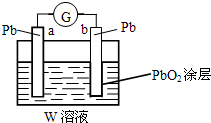 有A、B、C、D四种短周期元素,其原子序数依次增大.A、B可形成A2B和A2B2两种化合物,B、C同主族且可形成CB2和CB3两种化合物.回答下列问题.
有A、B、C、D四种短周期元素,其原子序数依次增大.A、B可形成A2B和A2B2两种化合物,B、C同主族且可形成CB2和CB3两种化合物.回答下列问题.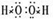

查看答案和解析>>
科目:高中化学 来源: 题型:
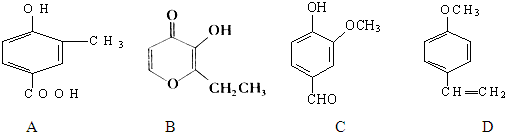
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com