
【题目】氮及其化合物在生产生活中有广泛应用.
(1)已知:CO可将部分氮的氧化物还原为N2 . 反应Ⅰ:2CO(g)+2NO(g)N2(g)+2CO2(g)△H=﹣746kJmol﹣1
反应Ⅱ:4CO(g)+2NO2(g)N2(g)+4CO2(g)△H=﹣1200kJmol﹣1
写出CO将NO2还原为NO的热化学方程式 .
(2)在密闭容器中充入5mol CO和4mol NO,发生上述反应I,图1为平衡时NO的体积分数与温度、压强的关系. 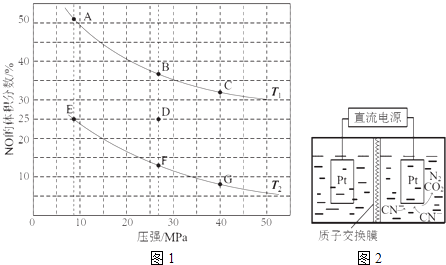
回答下列问题:
①温度:T1T2(填“<”或“>”).
②某温度下,在体积为2L的密闭容器中,反应进行10分钟放出热量373kJ,用CO的浓度变化表示的平均反应速率v(CO)= .
③某温度下,反应达到平衡状态D点时,容器体积为2L,此时的平衡常数K=(结果精确到0.01);若在D点对反应容器升温的同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中A~G点中的点
(3)某温度时,亚硝酸银AgNO2的 Ksp=9.0×10﹣4、Ag2SO4的Ksp=4.0×10﹣5 , 当向含NO2﹣、SO42﹣混合溶液中加入AgNO3溶液至SO42﹣恰好完全沉淀(即SO42﹣浓度等于1.0×10﹣5 molL﹣1)时,c(NO2﹣)= .
(4)如图2,在酸性条件下,电解水中CN﹣可转化为CO2和N2 , 请写出阳极的电极反应式 .
【答案】
(1)CO(g)+NO2(g)?CO2(g)+NO(g)△H=﹣227 kJ?mol﹣1
(2)>;0.05 mol?L﹣1?min﹣1;0.22 L?mol﹣1;A
(3)4.5×10﹣4 mol?L﹣1
(4)2CN﹣+4H2O﹣10e﹣=N2↑+2CO2↑+8H+
【解析】解:(1)已知:反应Ⅰ:2CO(g)+2NO(g)N2(g)+2CO2(g)△H=﹣746kJmol﹣1反应Ⅱ:4CO(g)+2NO2(g)N2(g)+4CO2(g)△H=﹣1200kJmol﹣1
根据盖斯定律, ![]() (Ⅱ﹣Ⅰ)得到CO(g)+NO2(g)CO2(g)+NO(g),)△H=
(Ⅱ﹣Ⅰ)得到CO(g)+NO2(g)CO2(g)+NO(g),)△H= ![]() (﹣1200kJmol﹣1+746kJmol﹣1)=﹣227 kJmol﹣1;
(﹣1200kJmol﹣1+746kJmol﹣1)=﹣227 kJmol﹣1;
所以答案是:CO(g)+NO2(g)CO2(g)+NO(g)△H=﹣227 kJmol﹣1;(2)①根据反应2CO(g)+2NO(g)N2(g)+2CO2(g)△H=﹣746kJmol﹣1 , 升高温度,平衡逆向移动,所以NO的体积分数会增大,即T1>T2 , 所以答案是:>;
②在体积为2L的密闭容器中,反应进行10分钟放出热量373kJ,根据反应:2CO(g)+2NO(g)N2(g)+2CO2(g)△H=﹣746kJmol﹣1 , 消耗CO的物质的量是 ![]() =1moL,v(CO)=
=1moL,v(CO)= ![]() =
= ![]() =0.05 molL﹣1min﹣1;所以答案是:0.05 molL﹣1min﹣1;
=0.05 molL﹣1min﹣1;所以答案是:0.05 molL﹣1min﹣1;
③某温度下,反应达到平衡状态D点时,NO的体积分数是25%,设CO的变化浓度是x,
2CO(g)+ | 2NO(g) | N2(g)+2 | 2CO2(g) | |
初始浓度: | 2.5 | 2 | 0 | 0 |
变化浓度: | X | x | 0.5x | x |
平衡浓度: | 2.5-x | 2-x | 0.5x | X |
NO的体积分数是25%,即 ![]() ×100%=25%,解得x=1,此时K=
×100%=25%,解得x=1,此时K= ![]() =0.22 Lmol﹣1;若在D点对反应容器升温的同时扩大体积使体系压强减小,则平衡会逆向移动,NO的体积分数增加,重新达到的平衡状态可能是图中A点,所以答案是:0.22 Lmol﹣1;A;(3)当向含NO2﹣、SO42﹣混合溶液中加入AgNO3溶液至SO42﹣恰好完全沉淀,根据Ag2SO4的Ksp=4.0×10﹣5 , 此时银离子浓度=
=0.22 Lmol﹣1;若在D点对反应容器升温的同时扩大体积使体系压强减小,则平衡会逆向移动,NO的体积分数增加,重新达到的平衡状态可能是图中A点,所以答案是:0.22 Lmol﹣1;A;(3)当向含NO2﹣、SO42﹣混合溶液中加入AgNO3溶液至SO42﹣恰好完全沉淀,根据Ag2SO4的Ksp=4.0×10﹣5 , 此时银离子浓度= ![]() =2.0,c(NO2﹣)=
=2.0,c(NO2﹣)= ![]() =4.5×10﹣4 molL﹣1;所以答案是:4.5×10﹣4 molL﹣1;(4)在酸性条件下,电解水中CN﹣可转化为CO2和N2 , 阳极上发生失电子的氧化反应,其电极反应式为:2CN﹣+4H2O﹣10e﹣=N2↑+2CO2↑+8H+ , 所以答案是:2CN﹣+4H2O﹣10e﹣=N2↑+2CO2↑+8H+ .
=4.5×10﹣4 molL﹣1;所以答案是:4.5×10﹣4 molL﹣1;(4)在酸性条件下,电解水中CN﹣可转化为CO2和N2 , 阳极上发生失电子的氧化反应,其电极反应式为:2CN﹣+4H2O﹣10e﹣=N2↑+2CO2↑+8H+ , 所以答案是:2CN﹣+4H2O﹣10e﹣=N2↑+2CO2↑+8H+ .
【考点精析】掌握化学平衡状态本质及特征和化学平衡的计算是解答本题的根本,需要知道化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】“天生我材必有用”,下列有关物质用途的叙述错误的是
A.硝酸可用于制炸药
B.氢氧化铝常用于治疗胃病
C.明矾具有消毒杀菌作用,可用于净水
D.硫磺有杀虫、杀螨、杀菌作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于烷烃性质的说法不正确的是( )
A.都是难溶于水的有机物
B.都能燃烧生成二氧化碳和水
C.其熔、沸点随着相对分子质量的增大而降低
D.其含碳量随着分子中碳原子个数增多而增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中处处有化学,下列有关说法正确的是
A. 糖类、蛋白质、脂肪都是人类需要的营养物质
B. 饮用矿泉水瓶、一次性水杯的主要成分是聚氯乙烯
C. 冬天用纯甘油涂抹在手和面部可以防止皮肤干燥和开裂
D. 大米富含淀粉,大米煮成粥后淀粉变成了葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组开展下列突验探究活动 
(1)装置A中反应的化学方程式为
(2)设计实验:利用装置1中产生的气体证明+4价硫具有氧化性
(3)选用下面的装置和药品探究亚硫酸与次氯酸的酸性强弱 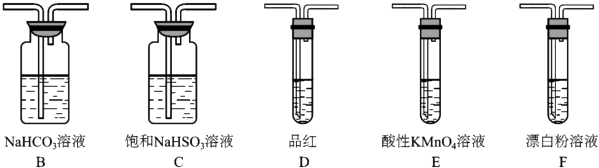
装置连接顺序为A,C, , , D,F,其中装置C的作用是 , 通过现象即可证明亚硫酸的酸性强于次氯酸
(4)利用G装置可测定装置A残液中SO2的含量,量取1.00mL残夜于烧瓶中,加适量的水稀释,加热使SO2全部溢出并与锥形瓶中H2O2完全反应SO2+H2O2=H2SO4然后用0.1000mol/L﹣1NaOH标准溶液进行滴定,至终点时消耗NaOH溶液20.00mL. ①图G中球形冷凝管进水口为(填“a”或“b”)
②残液中SO2含量为g.L﹣1
③经过多次测定发现,测定值始终高于实际值,则其原因是 . 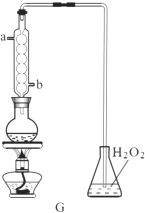
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】张亭栋研究小组受民间中医启发,发现As2O3(俗称砒霜)对白血病有明显的治疗作用.氮(N)、磷(P)、砷(As)等都是VA族的元素,该族元素的化合物在研究和生产中有许多重要用途.回答下列问题: 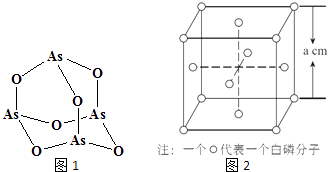
(1)As原子的核外电子排布式为 .
(2)P和S是同一周期的两种元素,P的第一电离能比S大,原因是 .
(3)NH4+中H﹣N﹣H的键角比NH3中H﹣N﹣H的键角(填“大”或“小”),原因是 .
(4)Na3AsO4中含有的化学键类型包括;AsO43﹣的空间构型为 , As4O6的分子结构如图1所示,则在该化合物中As的杂化方式是 .
(5)化合物NH5中的所有原子最外层都满足稳定结构,则NH5是晶体.
(6)白磷(P4)的晶体属于分子晶体,其晶胞结构如图2(小圆圈表示白磷分子).己知晶胞的边长为a cm,阿伏加德罗常数为NA mol﹣l , 则该晶胞中含有的P原子的个数为 , 该晶体的密度为gcm﹣3(用含NA、a的式子表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法不正确的是( ) ![]()
A.若甲既能与盐酸反应又能与NaOH溶液反应,则丙可能属于两性氧化物
B.若丙、丁混合产生白烟,且丙为18电子分子,则乙的水溶液可能具有漂白作用
C.若甲、丙、戊含有同一种元素,该元素的化合价由低到高的顺序可能为甲<丙<戊
D.若甲为短周期中原子半径最大的主族元素的单质,且戊为碱,则丙只能为Na2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项中的物质与其特征反应对应正确的是
选项 | 物质 | 特征反应 |
A | 油脂 | 遇浓硝酸变黄 |
B | 蛋白质 | 碱性条件下发生水解反应 |
C | 淀粉 | 常温下,遇碘化钾溶液变蓝 |
D | 葡萄糖 | 加热条件下,与新制Cu(OH)2反应生成砖红色沉淀 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下0.1molL﹣1醋酸溶液的pH=a,下列能使溶液pH=(a+1)的措施是( )
A.将溶液稀释到原体积的10倍
B.加入适量的醋酸钠固体
C.加入等体积0.2 molL﹣1盐酸
D.提高溶液的温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com