
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.5 | 1.7 | 2.3 | 3.0 | 0.8 |
| 微粒 | BeCl2 | H2S | NH3 | CO32- | BF3 |
| 中心原子杂化方式 | |||||
| 微粒的空间构型 |
分析 ①根据表中数据可知,元素的金属性越强,电负性越小,非金属性越强,电负性越大;
②由表中数据可知,同周期自左而右电负性增大,同主族自上而下电负性降低;
③根据电负性的差值判断;
④根据价层电子对互斥理论确定其空间构型,价层电子对个数=σ键个数+孤电子对个数,据此分析解答.
解答 解:(1)①根据表中数据可知,元素的金属性越强,电负性越小,非金属性越强,电负性越大,周期表中金属性最强的是Cs,所以电负性最小的是Cs,位于第六周期第IA族,其名称为铯,
故答案为:第六周期第IA族;铯;
②由表中数据可知,同周期自左而右电负性增大,同主族自上而下电负性降低,P的电负性小于N,大于Si,所以1.7<X(P)<2.3;Mg的电负性大于Al,小于Na,则0.9<X(Mg)<1.5,
故答案为:随着原子序数的增大而增大;1.7、2.3;0.9、1.5;
③当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键;Al的电负性为1.5,Cl的电负性为3.0,O的电负性为3.5,则Al与Cl的电负性差值为1.5,所以AlCl3中形成共价键,O与Al的电负性差值为2,所以Al2O3中形成离子键,
故答案为:共价键、离子键;
④BeCl2分子中Be原子的价层电子对个数=σ键个数+孤电子对个数=2+$\frac{1}{2}$(2-2×1)=2,因此N采取sp杂化,VSEPR构型为直线形,由于不含有孤电子对,所以其空间构型为直线形;
H2S分子中S原子的价层电子对个数=σ键个数+孤电子对个数=2+$\frac{1}{2}$(6-2×1)=4,因此N采取sp3杂化,VSEPR构型为四面体形,由于含有2个孤电子对,所以其空间构型为V形;
NH3分子中N原子的价层电子对个数=σ键个数+孤电子对个数=3+$\frac{1}{2}$(5-3×1)=4,因此N采取sp3杂化,VSEPR构型为四面体形,由于含有一个孤电子对,所以其空间构型为三角锥形;
CO32-中C原子的价层电子对个数=σ键个数+孤电子对个数=3+$\frac{1}{2}$(4+2-3×2)=3,因此N采取sp2杂化,VSEPR构型为平面三角形,由于不含有孤电子对,所以其空间构型为平面三角形;
BF3分子中B原子的价层电子对个数=σ键个数+孤电子对个数=3+$\frac{1}{2}$(3-3×1)=3,因此N采取sp2杂化,VSEPR构型为平面三角形,由于不含有孤电子对,所以其空间构型为平面三角形;
故答案为:
| 微粒 | BeCl2 | H2S | NH3 | CO32- | BF3 |
| 杂化方式 | sp | sp3 | sp3 | sp2 | sp2 |
| 空间构型 | 直线形 | V形 | 三角锥形 | 平面三角形 | 平面三角形 |
点评 本题考查电负性及与金属性非金属性的关系、杂化类型的判断和粒子空间构型等,题目难度中等,清楚主族元素电负性的递变规律、以及价层电子对互斥理论是解题关键,侧重于考查学生的分析能力和对基础知识的应用能力.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:选择题
| A. | 33% | B. | 40% | C. | 50% | D. | 67% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
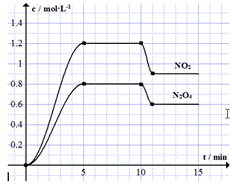 向容积固定为2L的密闭容器中充入9.6molNO和4.8molO2,发生如下反应:
向容积固定为2L的密闭容器中充入9.6molNO和4.8molO2,发生如下反应:| A. | 前5min反应的平均速率v(NO)=0.24mol•(L•min)-1 | |
| B. | T℃时反应①的化学平衡常数K=0.36 | |
| C. | 10min时改变反应条件可能是降低温度 | |
| D. | 若起始时向该容器中充入1.6mol NO2和4.0mol N2O4,T℃达到平衡时,NO2的物质的量浓度与图中5~10min的不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
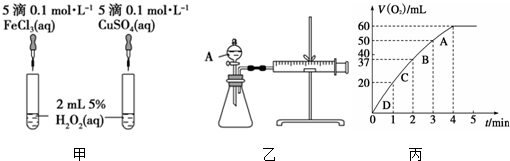
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | A | B | F |
| 原子半径/nm | 0.077 | 0.075 | 0.117 |
| 主要化合价 | +4、-4 | +5、-3 | +4、-4 |
| 元素 | D | M | G | E |
| 性质 结构 信息 | 单质制成的高压灯,发出的黄光透雾力强、射程远. | 氢化物常温下呈液态,M的双原子阴离子有18个电子 | 原子核外的M层比L层少2个电子. | +3价阳离子的核外电子排布与氖原子相同. |
 ,钙与A原子个数比为1:2化合物含有的化学键类型(填离子键、共价键或非极性键)离子键和非极性键共价键.
,钙与A原子个数比为1:2化合物含有的化学键类型(填离子键、共价键或非极性键)离子键和非极性键共价键.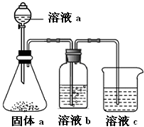
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应属于分解反应、放热反应 | |
| B. | 该反应瞬间能产生大量高温气体,推动飞船飞行 | |
| C. | 该反应把化学能转变为热能和动能 | |
| D. | 该反应反应物的总能量小于生成物的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 物质 | CaCl2 | H2O2 | AlCl3 | NH4Cl |
| 所含化学键类型 | 离子键、共价键 | 共价键 | 离子键 | 离子键、共价键 |
| 所属化合物类型 | 离子化合物 | 共价化合物 | 离子化合物 | 共价化合物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a>b>c | B. | b>a>c | C. | a=b+m+n | D. | a=c-n-m |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com