
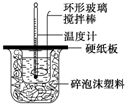
 某实验小组设计用50mL1.0mol/L盐酸跟50mL1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
某实验小组设计用50mL1.0mol/L盐酸跟50mL1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:| 实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
| 6.6℃+6.7℃+6.8℃ |
| 3 |
| cm△t |
| n(H2O) |
| 4.18×10-3KJ/(g?℃)×(50+50)mL×1.00g/mL×6.7℃ |
| 0.05L×1.0mol/L |


科目:高中化学 来源: 题型:
 硫元素有多种化合价,可形成多种化合物.
硫元素有多种化合价,可形成多种化合物.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5mol | ||
| B、3mol | ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 实验结论 |
| ①氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 | 氧化性从强到弱的顺序:氯、溴、碘 |
| ②NaBr溶液+氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 | |
| ③KI溶液+氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、7:2 | B、2:7 |
| C、1:7 | D、7:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、洗净的锥形瓶和容量瓶可以放进烘箱中烘干 |
| B、用容量瓶配制溶液时,若加水超过刻度线,立即用滴管吸出多余的液体 |
| C、加热坩埚时需垫石棉网 |
| D、用分液漏斗分液时,上层液体应从上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
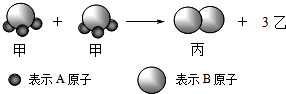 如图所示2个甲分子反应生成1个丙分子和3个乙分子,下列判断不正确的是( )
如图所示2个甲分子反应生成1个丙分子和3个乙分子,下列判断不正确的是( )| A、1个乙分子中含有2个A原子 |
| B、该反应类型是分解反应 |
| C、该反应一定属于氧化还原反应 |
| D、摩尔质量关系为:2M (甲)=M (乙)+M (丙) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com