
【题目】A,B,C,D,E五种元素中,A原子3p轨道上成对电子数等于未成对电子数,B原子核外电子分处3个不同能级,且每个能级上排布的电子数相同,C的价电子排布式为nsnnpn+2 , D的核电荷数是A与C的核电荷数之和,E在元素周期表的各元素中电负性最大.请回答下列问题:
(1)A的最高价氧化物的化学式为 , 中心原子的VSEPR构型为 .
(2)AC2与BC2分子的立体结构分别是和 , 相同条件下两者在水中的溶解度较大的是(写分子式),理由是 .
(3)D的元素符号是 , 它的核外电子排布式的简化式为 .
(4)用氢键表示写出E的氢化物的水溶液中存在的所有氢键 .
【答案】
(1)SO3;平面三角形
(2)V形;直线形;SO2;CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶原理”SO2在H2O中溶解度较大
(3)Cr;[Ar]3d54s1
(4)F﹣H…F、O﹣H…O、F﹣H…O、O﹣H…F
【解析】解:A原子3p轨道上成对电子数等于未成对电子数,原子核外电子排布为1s22s22p63s22p4 , 则A为S元素;B原子核外电子分处3个不同能级,且每个能级上排布的电子数相同,原子核外电子排布为1s22s22p2 , 则B为C元素;C的价电子排布式为nsnnpn+2 , s能级最多容纳2个电子,且p能级填充电子,则n=2,故C为O元素;D的核电荷数是A与C的核电荷数之和,则D的核电荷数为16+8=24,故D为Cr;E在元素周期表的各元素中电负性最大,则E为F元素.(1)A为S元素,最高价氧化物的化学式为SO3 , 中心S原子的价层电子对数=3+ ![]() =3,VSEPR构型为平面三角形,
=3,VSEPR构型为平面三角形,
所以答案是:SO3;平面三角形;(2)SO2分子中S原子孤电子对数= ![]() =1,价层电子对数=2+1=3,故空间构型为V形,CO2分子是直线形结构,CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶原理”SO2在H2O中溶解度较大,
=1,价层电子对数=2+1=3,故空间构型为V形,CO2分子是直线形结构,CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶原理”SO2在H2O中溶解度较大,
所以答案是:V形;直线形;SO2;CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶原理”SO2在H2O中溶解度较大;(3)D的元素符号是Cr,它的核外电子排布式的简化式为:[Ar]3d54s1 ,
所以答案是:Cr;[Ar]3d54s1;(4)E的氢化物为HF,其水溶液中HF分子之间存在氢键、水分子之间存在氢键、HF与水分子之间形成2种氢键,存在的所有氢键有:F﹣H…F、O﹣H…O、F﹣H…O、O﹣H…F,
所以答案是:F﹣H…F、O﹣H…O、F﹣H…O、O﹣H…F.


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
【题目】室温下向10mLpH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中导电粒子的数目减少
B.溶液中 ![]() 不变
不变
C.醋酸的电离程度增大,c(H+)亦增大
D.再加入10mLpH=11的NaOH溶液,混合液的pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)俗称大苏打,主要用于照相业作定影剂.Na2S2O3易溶于水,在酸性溶液中会迅速分解,具有较强的还原性.
(1)Na2S2O3溶液与足量氯水反应的离子方程式为 . (S元素被氧化为SO ![]() )
)
(2)硫代硫酸钠(Na2S2O3)露置在空气中易氧化变质,其可能的变质后生成物如下:假设一:
假设二:只有Na2SO4固体
假设三:
(3)现有一瓶Na2S2O3固体,可能混有Na2SO4固体.设计实验验证该假设,写出实验步骤、预期现象和结论.限选试剂:1molL﹣1 H2SO4、1molL﹣1HNO3、1molL﹣1HCl、1molL﹣1NaOH、0.1molL﹣1BaCl2、0.01molL﹣1KMnO4、蒸馏水.
实验步骤 | 预期现象和结论 |
步骤1:取少量固体于试管中,加蒸馏水溶解. | |
步骤2: | |
步骤3: |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的Cl 2 通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO- 和ClO3-两种离子的物质的量( n )与反应时间( t )的变化示意图如图所示。 下列说法正确的是( )
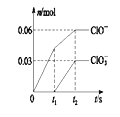
A. 苛性钾溶液中KOH的物质的量为0.18mol
B. 反应中转移电子的物质的量是0.09 mol
C. 在酸性条件下ClO- 和ClO3-能反应得到氯气
D. ClO3-的生成可能是由于温度升高引起的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A,B,C,D,E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中A,B,C是同一周期的非金属元素.化合物DC为离子化合物,D的二价阳离子与C的阴离子具有相同的电子层结构.AC2为产生温室效应的主要气体.B,C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E的原子序数为24,ECl3能与B,C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2:1,三个氯离子位于外界.请根据以上情况,回答下列问题:(答题时,A,B,C,D,E用所对应的元素符号表示)
(1)A,B,C的第一电离能由小到大的顺序为 .
(2)B的氢化物分子的立体构型是 , 其中心原子采取杂化.
(3)写出化合物AC2的电子式;一种由B,C组成的化合物与AC2互为等电子体,其化学式为 .
(4)E的核外电子排布式是 , ECl3形成的配合物的化学式为 .
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿为自然界中铝的重要存在形式,通常含有 50﹪左右的 Al2O3,以及 SiO2、Fe2O3 和 MgO 等成分。上述 4 种氧化物中,属于两性氧化物的是
A. Al2O3 B. SiO2 C. Fe2O3 D. MgO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是用98%的浓H2SO4(ρ=1.84g/cm3)配制500mL 0.5molL﹣1的稀硫酸的实验操作,请按要求填空:
(1)实验中量取浓硫酸的体积为mL.
(2)如果实验室有10mL、20mL、50mL的量筒,应选规格的量筒最好,如果量取浓硫酸时仰视读数,所配溶液浓度将(填“偏高”、“偏低”或“无影响”) .
(3)将量取的浓硫酸沿烧杯内壁慢慢注入盛有约少量水的烧杯里,并不断搅拌,搅拌的目的是 .
(4)将冷却至室温的上述溶液沿玻璃棒注入中,并用50mL蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液要转入到容量瓶中,并振荡;在转移过程中有少量液体洒在桌子是,则最终所配浓度将(填“偏高”、“偏低”或“无影响”) .
(5)加水至距刻度线1~2cm处,改用加水至刻度线,使溶液的凹液面恰好跟容量瓶刻度线相平,把容量瓶塞好,反复颠倒振荡,摇匀溶液.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com