
下列各组微粒中,都互为等电子体的是( )
|
| A. | CO、NO、NaH、N2 | B. | SO2、NO2+、N3﹣、OCN﹣ |
|
| C. | CO32﹣、NO3﹣、BCl3 | D. | SiF4、SiO44﹣、SO32﹣、PO43﹣ |
考点:
“等电子原理”的应用.
分析:
原子个数相等、价电子数相等的微粒称为等电子体,原子或化合物中,电子数=质子数,阳离子中电子数=质子数﹣电荷数,阴离子中电子数=质子数+电荷数,据此分析解答.
解答:
解:A.CO、N2中电子数是14,NO中电子数是15,NaH中电子数是12,所以这几种微粒不是等电子体,故A错误;
B.SO2中价电子数是24、NO2+中价电子数是16、N3﹣中价电子数是16、OCN﹣中价电子数是16,所以NO2+、N3﹣、OCN﹣属于等电子体,故B错误;
C.CO32﹣中价电子数是24、NO3﹣中价电子数是24、BCl3中价电子数是24,且含有原子个数相等,所以属于等电子体,故C正确;
D.SiF4中价电子数是32、SiO44﹣中价电子数是32、SO32﹣中价电子数是24、PO43﹣中价电子数是32,且SiF4、SiO44﹣、PO43﹣中原子个数相等,所以属于等电子体,故D错误;
故选C.
点评:
本题考查等电子体的判断,侧重考查对概念的理解,明确原子结构是解本题关键,会计算价电子数,题目难度不大.


科目:高中化学 来源: 题型:
现有一定体积的HCl气体,将其溶于100mL稀硫酸中,假设溶液的体积不变,向混合溶液中加入4mol•L﹣1的NaOH溶液10mL恰好呈中性.继续向所得中性溶液中滴入过量的Ba(OH)2溶液,所得沉淀质量为2.33g.
(1)生成沉淀的化学方程式为: .
(2)硫酸的物质的量浓度:c(H2SO4)= .
(3)该HCl气体在标准状况下的体积为 mL.
(4)若向该混酸溶液(仍为100mL)中加入Na2CO3•10H2O晶体,直到不再产生气体时为止,消耗Na2CO3•10H2O晶体的质量为 g.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实与氢键有关的是( )
|
| A. | HF、HCl、HBr、HI的热稳定性依次减弱 |
|
| B. | 水加热到很高的温度都难以分解 |
|
| C. | CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高 |
|
| D. | 水结成冰体积膨胀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
Pt(NH3)2Cl2可以形成两种固体,一种为淡黄色,在CCl4中的溶解度大,另一种为黄绿色,在CCl4中的溶解度较小,请回答下列问题:
(1)Pt(NH3)2 Cl2是平面正方形结构,还是四面体结构
(2)请在以下空格内画出这两种固体分子的几何构型图,淡黄色固体: 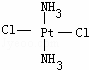 ,黄绿色固体:
,黄绿色固体:
(3)淡黄色固体物质是由 分子组成,黄绿色固体物质是由
分子组成(填“极性分子”或“非极性分子”)
(4)黄绿色固体在CCl4中溶解度比淡黄色固体小,原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
规范书写是我们学习中必须遵循的原则,小明在元素周期表中查找到如图所示的一格后,明白了不能把一氧化碳写成“Co”的原因.
(1)“Co”表示 元素(填名称);
(2)“CO”是由 两种元素(填名称)组成的 (填“单质”或“化合物”).

查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是()
A. 乙酸与碳酸钠溶液反应:2H++CO32﹣═CO2↑+H2O
B. 醋酸溶液与新制氢氧化铜反应:2CH3COOH+Cu(OH)2→Cu2++2CH3COO﹣+2H2O
C. 苯酚钠溶液中通入少量二氧化碳:2C6H5O﹣+CO2+H2O 2C6H5OH+CO32﹣
2C6H5OH+CO32﹣
D. 甲醛溶液与足量的银氨溶液共热:HCHO+4[Ag(NH3)2]++4OH﹣ CO32﹣+2NH4++4Ag↓+6NH3+2H2O
CO32﹣+2NH4++4Ag↓+6NH3+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com