
分析 (1)计算钠元素质量分数,再根据n=$\frac{m}{M}$计算Na、S原子数目之比,进而确定x的值;
(2)生成的气体为H2S,计算H2S的物质的量,根据方程式计算多硫化钙的物质的量,再根据c=$\frac{n}{V}$计算多硫化钙的物质的量浓度;
由方程式可知CaS2O3的物质的量是多硫化钙的$\frac{1}{2}$,再根据m=nM计算其质量,根据m=ρV计算石硫合剂的走过来,进而计算CaS2O3的质量分数;
(3)根据元素守恒,结合n=$\frac{m}{M}$可知氢氧化钙和硫磺的物质的量之比1:4,反应方程式为:3Ca(OH)2+12S$\frac{\underline{\;\;△\;\;}}{\;}$2CaSx+CaS2O3+3H2O,据此解答;
(4)n(CaO)=$\frac{50.4g}{56g/mol}$=0.9mol,n(S)=$\frac{96g}{32g/mol}$=3mol,则 n[Ca(OH)2]:n(S)=0.9mol:3mol=3:10,由反应可知:3Ca(OH)2+10S$\frac{\underline{\;\;△\;\;}}{\;}$2CaSx+CaS2O3+3H2O,解之得:x=4,即多硫化物中硫原子的平均值为4,故另两种多硫化物可能为:CaS2与CaS5或CaS3与CaS5,根据平均S原子数目,利用十字交叉法计算二者物质的量之比.
解答 解:(1)硫元素的质量分数为0.736,则钠元素的质量分数为1-0.736=0.264,所以钠原子和硫原子的个数之比是$\frac{\frac{0.264}{23}}{\frac{0.726}{32}}$=$\frac{1}{2}$,所以x=2×2=4,故答案为:4;
(2)硫化氢为$\frac{11.2L}{22.4L/mol}$=0.05mol,所以根据方程式:Sx2-+2H2O+2CO2→(x-1)S↓+H2S↑+2HCO3-,可知多硫化钙的物质的量是0.05mol,其浓度是0.05mol÷0.25L=0.20 mol/L;
由3Ca(OH)2+8S$\stackrel{△}{→}$2CaS3+CaS2O3+3H2O;3Ca(OH)2+6S$\stackrel{△}{→}$2CaS2+CaS2O3+3H2O,可知CaS2O3的物质的量是0.05mol÷2=0.025mol,所以其质量分数是$\frac{0.025mol×152g/mol}{250mL×1.12g/mL}$=0.014,
故答案为:0.20mol/L;0.014;
(3)生石灰、硫磺的质量比7:16,则物质的量之比是$\frac{7}{56}$:$\frac{16}{32}$=1:4,即氢氧化钙和硫磺的物质的量之比是1:4,所以方程式为:3Ca(OH)2+12S$\stackrel{△}{→}$2CaSx+CaS2O3+3H2O,多硫化钙与硫代硫酸钙的物质的量之比是2:1,根据S原子守恒则x=5,多硫化钙的化学式是CaS5,
故答案为:2:1;CaS5;
(4)n(CaO)=50.4/56=0.3mol n(S)=96/32=3mol
则 n[Ca(OH)2]:n(S)=3:10 由反应可知:3Ca(OH)2+10S$\frac{\underline{\;\;△\;\;}}{\;}$2CaSx+CaS2O3+3H2O,
解之得:x=4 即多硫化物中硫原子的平均值为4.
故另两种多硫化物可能为:CaS2与CaS5或CaS3与CaS5.
由 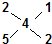 可知,n(CaS2):n(CaS5)=1:2;
可知,n(CaS2):n(CaS5)=1:2;
由 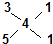 可知,n(CaS3):n(CaS5)=1:1;
可知,n(CaS3):n(CaS5)=1:1;
答:二种多硫化钙可能的物质的量之比为n(CaS2):n(CaS5)=1:2;n(CaS3):n(CaS5)=1:1.
点评 本题考查混合物有关计算,侧重考查学生分析计算难度,关键是对化学方程式的理解与书写,题目计算量大,难度较大.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:选择题
| A. | HNO3 | B. | HCO3- | C. | NH4+ | D. | SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烷分子的比例模型: | B. | 聚丙烯的结构简式: | ||
| C. | 乙酸的实验式为:CH2O | D. | 化学名词:乙酸乙脂、苯、钳锅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8 g苯含有碳碳双键的数目为0.3NA | |
| B. | 标准状况下,足量的Fe与2.24 L Cl2反应转移电子的数目为0.3NA | |
| C. | 273K、101kPa下,28 g乙烯与丙烯混合物中含有C-H键的数目为5NA | |
| D. | 100 mL1mol•L-1的NaF中:N(F-)+N(HF)=0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠溶液水解的离子方程式:CO32-+2H2O=H2CO3+2OH- | |
| B. | 甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| C. | 氢氧化钡在水溶液中的电离方程式:Ba(OH)2=Ba2++2OH- | |
| D. | 向含Al(OH)3白色沉淀的溶液中不断通CO2沉淀逐渐溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 质量相等时,三种气体所含原子数相等 | |
| B. | 质量相等时,三种气体所含氮原子数相等 | |
| C. | 所含氮原子数相等时,三种气体的质量相等 | |
| D. | 质量相等时,二氧化氮所含氧原子数比一氧化氮所含氧原子数多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 鸡蛋清的水溶液加饱和(NH4)2SO4溶液后,有白色物质析出 | |
| B. | NO2气体经加压变成无色液体 | |
| C. | 溴水滴入植物油中振荡褪色 | |
| D. | 用SO2漂白的草帽日久变黄 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com