
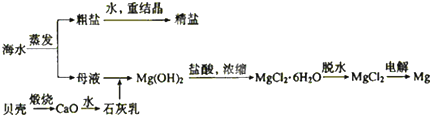


科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.炼铜:用黄铜矿(主要成分为CuFeS2)直接电解精炼得到纯度为99.9%的铜 |
| B.制铝:工业上电解氯化铝来制备铝 |
| C.制钠:电解饱和NaCl溶液 |
| D.炼铁:用CO在高温下还原铁矿石中的铁 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.工业上电解熔融AlCl3制取金属铝 |
| B.镁在空气中燃烧的产物只有MgO |
| C.海水提镁和海水提取溴所涉及的化学反应全部是氧化还原反应 |
| D.铜表面形成的铜绿的主要成分为Cu2(OH)2CO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
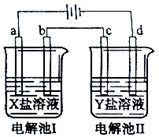
| 选项 | X | Y |
| A. | MgSO4 | CuSO4 |
| B. | AgNO3 | Pb(NO3)2 |
| C. | FeSO4 | Al2 (SO4)3 |
| D. | CuSO4 | AgNO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在电解池的阴极和原电池的负极上都发生氧化反应 |
| B.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 |
| C.用惰性电极电解KOH溶液,阴、阳两极产物的物质的量之比为1:2 |
| D.用惰性电极电解饱和NaCl溶液,若有lmol电子转移,则生成l molNaOH |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 等离子,电极为惰性电极。下列叙述中正确的是
等离子,电极为惰性电极。下列叙述中正确的是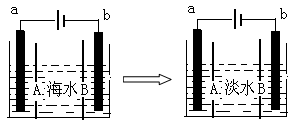
| A.A膜是阳离子交换膜 |
| B.通电后,海水中阴离子往b电极处运动 |
| C.通电后,b电极上产生无色气体,溶液中出现白色沉淀 |
| D.通电后,a电极的电极反应式为:4OH--4e- = O2↑+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com