
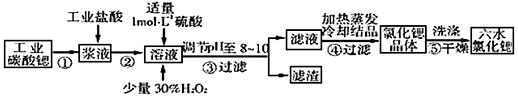
锶(Sr)为第五周期第II A族元素。高纯六水氯化锶晶体(SrCl2·6H2O)具有很高的经济价值,用工业碳酸锶粉末(含少量钡、铁的化合物等杂质)制备高纯六水氯化锶晶体的过程如下图所示。

已知:SrCl2·6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。请回答:
(1)操作①加快反应速率的措施有 (任写一种方法)。碳酸锶与盐酸反应的离子方程式为 。
(2)加入少量30% H2O2溶液的发生反应的离子方程式为 。
(3)步骤③中调节溶液pH至8—10,宜选用的试剂为_______(填序号):
A.氨水 B.氢氧化钠 C. 氢氧化锶粉末 D.碳酸钠晶体
所得滤渣的主要成分是Fe(OH)3和 (填化学式)。
(4)工业上用热风吹干六水氯化锶,选择的适宜温度范围是 。
A.50~60℃ B.70~80℃ C.80~100℃ D.100℃以上
(5)若滤液中Ba2+ 浓度为1×10-5mol/L,依下表数据推算出滤液中Sr2+物质的量浓度不大于 mol/L。
|
|
SrSO4 |
BaSO4 |
Sr(OH)2 |
|
Ksp |
3.3×10—7 |
1.1×10—10 |
3.2×10—4 |
(16分)
(1)(共5分)升高温度、或增大盐酸浓度、或充分搅拌等(合理均可,2分)
SrCO3+2H+=Sr2++CO2↑+H2O (3分)
(2)(共3分)2Fe2++H2O2+2H+=2Fe3++2H2O
(3)(共4分)C(2分) BaSO4(2分)
(4)(共2分) A
(5)(共2分)0.03(或3×10-2)
[计算过程:c(SO42-)=1.1×10-10÷10-5 mol•L-1=1.1×10-5 mol•L-1,c(Sr2+)=3.3×10-7÷1.1×10-5 mol•L-1=3×10-2 mol•L-1]
【解析】
试题分析:(1)根据影响化学反应速率的因素,升高温度、或增大盐酸浓度、或充分搅拌等都能加快反应速率;盐酸的酸性比碳酸强,因此碳酸锶与盐酸能发生复分解反应,同主族元素具有相似性,镁、钙、锶、钡都是第IIA族,碳酸镁微溶、碳酸钙难溶、碳酸钡难溶,由此推断碳酸锶难溶于水,应保留化学式,则该反应为SrCO3+2H+=Sr2++CO2↑+H2O;
(2)铁的化合物溶于盐酸时可能生成亚铁离子和铁离子,双氧水具有强氧化性,是绿色氧化剂,可以将亚铁离子氧化为铁离子,即2Fe2++H2O2+2H+=2Fe3++H2O,便于除铁;
(3)氨水与氢离子容易结合成铵根离子,虽然能消耗氢离子,升高溶液的pH,但是引入的铵根离子是新的杂质,故A选项错误;氢氧化钠也能消耗氢离子,达到调节溶液pH的目的,但是引入的钠离子是新的杂质,故B选项错误;氢氧化锶能消耗氢离子,将溶液pH调至8~10,且引入的锶离子是目标产物需要的离子,故C选项正确;碳酸钠能消耗氢离子,但是会引入钠离子,故D选项错误;由于钡的化合物溶于盐酸产生钡离子,加入过量硫酸时,硫酸根离子与钡离子结合生成硫酸钡沉淀,则滤渣的主要成分是氢氧化铁和硫酸钡;
(4)由于SrCl2·6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水,为了减少目标产物的损失,不能使温度达到61℃或61℃以上,故只有A选项正确;
(5)由于BaSO4(s)  Ba2++SO42—,Ksp(BaSO4)=c(Ba2+)•c(SO42—),则滤液中c(SO42—)= 1.1×10—10÷1×10-5 mol/L
=1.1×10—5mol/L,由于SrSO4(s)
Ba2++SO42—,Ksp(BaSO4)=c(Ba2+)•c(SO42—),则滤液中c(SO42—)= 1.1×10—10÷1×10-5 mol/L
=1.1×10—5mol/L,由于SrSO4(s)  Ba2++SO42—,为了防止锶离子沉淀,则Qc(SrSO4)=c(Sr2+)•c(SO42—)≤Ksp(SrSO4),则滤液中c(Sr2+)≤3.3×10—7÷1.1×10-5 mol/L
=3.0×10—2mol/L。
Ba2++SO42—,为了防止锶离子沉淀,则Qc(SrSO4)=c(Sr2+)•c(SO42—)≤Ksp(SrSO4),则滤液中c(Sr2+)≤3.3×10—7÷1.1×10-5 mol/L
=3.0×10—2mol/L。
考点:考查物质制备化学工艺流程,涉及加快酸浸反应速率的措施、盐酸与碳酸锶反应的离子方程式、加入过氧化氢时反应的离子方程式、选择合理的试剂调节溶液pH除杂、滤渣的成分、选择合适的烘干温度、硫酸钡和硫酸锶溶度积的计算等。


科目:高中化学 来源: 题型:阅读理解


查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省德州市高三1月月考化学试卷(解析版) 题型:填空题
某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,某研究性学习小组欲分析其成分,实验记录如下图所示。
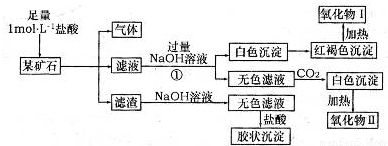
(1)该矿石中含有 (填化学式),请写出实验过程①中反应的离子方程式 。
(2)将氧化物Ⅱ在熔融状态下电解,可以得到某金属单质。当阳极上收集到气体33.6L(已折算成标准状况)时,阴极上得到该金属 g。
(3)试写出该金属与氧化物I反应的化学方程式 ;将该反应的产物加入到足量烧碱溶液中,请写出发生反应的离子方程式 。
(4)经进一步分析该矿石中还含有微量的SrCO3(上述方案检测不出)。锶(Sr)为第五周期ⅡA族元素。下列叙述正确的是 (填序号)。
①氯化锶(SrCl2)溶液显酸性
②SrSO4难溶于水
③工业上可以用电解SrCl2的水溶液制取金属锶(Sr)
④高纯六水氯化锶晶体(SrCl2·6H2O)必须在HCl氛围中加热才能得到SrCl2
查看答案和解析>>
科目:高中化学 来源:2014届浙江省温州市十校联合体高三上学期期初联考化学试卷(解析版) 题型:实验题
锶(Sr)为第五周期ⅡA族元素。高纯六水氯化锶晶体(SrCl2•6H2O)具有很高的经济价值,61℃时晶体开始失去结晶水,100℃时失去全部结晶水。用工业碳酸锶粉末(含少量Ba、Fe的化合物)制备高纯六水氯化锶的过程如下图:
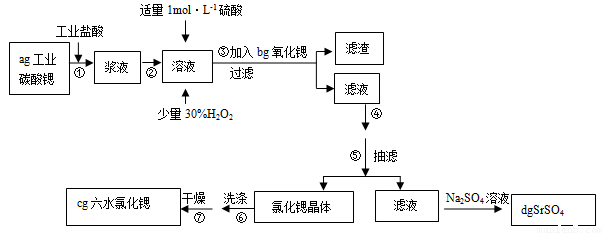
请回答:
(1)加入少量30%H2O2的作用 (用离子方程式表示);
(2)步骤③中氧化锶粉末的作用是 ,工业上用50~60℃热风吹干六水氯化锶,选择该温度的原因是 ;
(3)步骤④进行的实验操作为 、 ,步骤⑥中,洗涤氯化锶晶体最好选用 ;
A.水 B.硫酸 C.氢氧化钠溶液 D.氯化锶饱和溶液
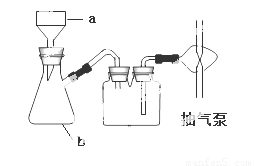
(4)指出下图中仪器b 的名称 , 在抽滤时使滤纸紧贴布氏漏斗瓷板的操作是 ,抽气使滤纸紧贴在漏斗瓷板上;
(5)计算原工业碳酸锶粉末中碳酸锶的质量分数 (列计算式即可)。
查看答案和解析>>
科目:高中化学 来源:广东省模拟题 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com