
实验室制备乙酸乙酯的反应和实验装置如下:
CH3COOH + C2H5OH  CH3COOC2H5 + H2O
CH3COOC2H5 + H2O
投料 1 : 1 产率 65%
1 : 10 97%
(在120 ℃下测定)

已知:相关物理性质(常温常压)
| 密度g/mL | 熔点/℃ | 沸点/℃ | 水溶性 |
乙醇 | 0.79 | -114 | 78 | 溶 |
乙酸 | 1.049 | 16.2 | ~117 | 溶 |
乙酸乙酯 | 0.902 | ?84 | ~76.5 | 不溶 |
合成反应:
在三颈瓶中加入乙醇5 mL,硫酸5 mL,2小片碎瓷片。漏斗加入乙酸14.3 mL ,乙醇20 mL。冷凝管中通入冷却水后,开始缓慢加热,控制滴加速度等于蒸馏速度,反应温度不超过120 ℃。
分离提纯:
将反应粗产物倒入分液漏斗中,依次用少量饱和的Na2CO3溶液、饱和NaCl溶液、饱和CaCl2溶液洗涤,分离后加入无水碳酸钾,静置一段时间后弃去碳酸钾。最终通过蒸馏得到纯净的乙酸乙酯。
回答下列问题:
(1)酯化反应的机制
用乙醇羟基氧示踪

用醋酸羟基氧示踪


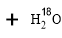
含氧18水占到总水量的一半,酯也一样。这个实验推翻了酯化反应为简单的取代反应。请你设想酯化反应的机制 。
(2)酯化反应是一个可逆的反应,120 ℃时,平衡常数K= 。
为了使正反应有利,通常采用的手段是:
①使原料之一过量。谁过量 ?
无水乙醇3600元/吨,冰醋酸2900元/吨。每摩乙醇 元,每摩冰醋酸 元。
②不断移走产物[例如除水,乙酸乙酯、乙醇、水可形成三元恒沸物(沸点:70.2 ℃),乙酸不能形成三元恒沸物]。综上所述选择 过量。
(3)加入碎瓷片的作用是________;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________(填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(4)浓硫酸与乙醇如何混合? 。
(5)控制滴加乙酸和乙醇混和液的速度等于蒸馏速度目的是? 。
(6)蒸出的粗乙酸乙酯中主要有哪些杂质? 。
饱和的Na2CO3溶液洗涤除去乙酸。如何判断是否除净? 。
用饱和NaCl溶液洗涤除去残留的Na2CO3溶液,为什么不用水? 。
用饱和CaCl2溶液直接洗涤起什么作用: 。
(1)先加成反应生成 后消去失水,失水有两种可能分别生成
后消去失水,失水有两种可能分别生成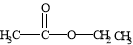 和
和  (2分)
(2分)
(2)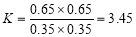 (2分) ① 0.1656 (1分) 0.174 (1分)
(2分) ① 0.1656 (1分) 0.174 (1分)
②乙醇 (1分)
(3)防暴沸 (1分) B (1分)
(4)先加入乙醇后加入硫酸,边振荡加滴加。(1分)
(5)保证乙醇量是乙酸量10倍以上,提高乙酸的转化率。(1分)
(6)乙醚、乙酸、乙醇和水(1分) pH试纸检验不显酸性(1分)
减少乙酸乙酯溶解(1分) 除去少量的乙醇(1分)
【解析】
试题分析:(1)用醋酸羟基氧示踪
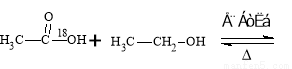

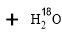
将C—O单键变C=O的是消去反应。而含氧18水占到总水量的一半,酯也一样。说明是同一个碳原子上存在—OH和—18OH两个羟基。酯化反应的机制为先加成反应生成 后消去失水,失水有两种可能分别生成
后消去失水,失水有两种可能分别生成 和
和  。
。
(2)酯化反应是一个可逆的反应,120 ℃时,平衡常数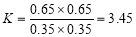 。
。
①因无水乙醇3600元/吨,每摩乙醇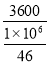 =0.1656元;
=0.1656元;
冰醋酸2900元/吨。每摩冰醋酸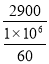 =0.174元。
=0.174元。
使原料之一过量,应为价格低廉的乙醇。
(3)加入碎瓷片的作用是防暴沸;如果加热一段时间后发现忘记加瓷片,反应液的温度过高,应该采取的正确操作是冷却后补加。
(4)浓硫酸与乙醇混合属于浓硫酸的稀释,先加入乙醇后加入硫酸,边振荡加滴加。
(5)控制滴加乙酸和乙醇混和液的速度等于蒸馏速度目的是保证乙醇量是乙酸量10倍以上,提高乙酸的转化率。
(6)根据乙酸、乙醇之间和乙醇本身的反应,蒸出的粗乙酸乙酯中主要含有乙醚、乙酸、乙醇和水。
饱和的Na2CO3溶液洗涤除去乙酸。pH试纸检验不显酸性判断已经除净乙酸。用饱和NaCl溶液洗涤除去残留的Na2CO3溶液,是微粒减少乙酸乙酯溶解。用饱和CaCl2溶液直接洗涤可以除去少量的乙醇。
考点:化学实验设计。考查反应物的混合方法及其计量与转化率的关系;产品杂质的确定与提纯方法。


科目:高中化学 来源:2013-2014河南省濮阳市高二下学期升级考试化学试卷(解析版) 题型:选择题
已知温度T时水的离子积常数为 。该温度下,将浓度为amol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
。该温度下,将浓度为amol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
A.a=b
B.混合溶液的pH=7
C.混合溶液中,
D.混合溶液中,
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省濮阳市高一下学期升级考试化学(A卷)试卷(解析版) 题型:选择题
能在无色溶液中大量共存的一组离子是
A.Cu2+、SO42—、OH—、K+ B.Fe3+、Cl—、NO3—、H+
C.K+、CO32—、Cl— 、H+ D.H+、Na+、Cl—、SO42—
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省洛阳市高三年级第三次考试理综化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z的原子序数依次增大,Y为IA族元素,X与Z同主族,3种元素原子的最外层电子数之和为13,下列判断正确的是
A.Y元素位于第2周期 B.Y、Z均能与X形成不只一种化合物
C.X是ⅤA族元素 D.氢化物的稳定性:HnZ > HnX
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省洛阳市高三下学期统考二练理综化学试卷(解析版) 题型:推断题
化合物F是一种重要的有机合成中间体,它的合成路线如下:
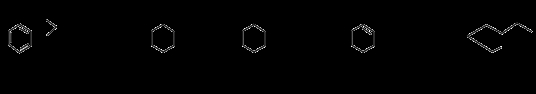
(1)化合物F中含氧官能团的名称是 和 ,由B生成C的化学反应类型是 。
(2)写出化合物C与乙酸反应生成酯的化学方程式:
(3)写出化合物B的结构简式 。
(4)某化合物是D的同分异构体,且分子中只有三种不同化学环境的氢原子。写出该
化合物的结构简式 (任写一种)。
(5)请根据已有知识并结合相关信息,写出以苯酚(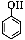 )和CH2=CH2为原料制备
)和CH2=CH2为原料制备
有机物 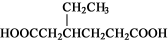 的合成路线流程图(无机试剂任用)。
的合成路线流程图(无机试剂任用)。
合成路线流程图示例如下:
H2C== CH2 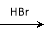 CH3CH2Br
CH3CH2Br  CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省洛阳市高三下学期统考二练理综化学试卷(解析版) 题型:选择题
符合下列条件的有机物同分异构体共有(不考虑立体异构) ( )
①分子式为C6H14O ②在铜或银催化剂的条件下可以被空气中的氧气氧化为醛
A.6种 B.7种 C.8种 D.9种
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省洛阳市下学期期中考试高二化学试卷(解析版) 题型:选择题
五种物质中:

(1)能与NaOH溶液反应的有________(填写序号,下同);
(2)能发生银境反应的有________;
(3)既能发生酯化反应,又能发生消去反应的有___________;
(4)能和NaHCO3反应的有______________.
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省洛阳市下学期期中考试高二化学试卷(解析版) 题型:选择题
某有机物在氧气中充分燃烧,生成的CO2和H2O的物质的量之比为1:2,则下列说法中正确的是
A.分子中C、H、O原子个数之比为1:2:3 B.分子中C、H个数之比为1:2
C.分子中可能含有氧原子 D.此有机物的分子式一定为CH4
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省商丘市高三第三次模拟考试理综化学试卷(解析版) 题型:推断题
现有一瓶标签上注明为葡萄糖酸盐(钠、镁、钙、铁)的复合制剂,某同学为了确认其成分,取部分制剂作为试液,设计并完成了如下实验:(已知:控制溶液pH=4时,Fe(OH)3沉淀完全,Ca2+、Mg2+不沉淀)该同学得出的结论正确的是

A.根据现象1可推出该试液中含有Na+
B.根据现象2可推出该试液中并不含有葡萄糖酸根
C.根据现象3和4可推出该试液中含有Ca2+,但没有Mg2+
D.根据现象5可推出该试液中一定含有Fe2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com