
����Ŀ���Ȼ�����Ʒ�к�������̼��ء�����غͲ�����ˮ�����ʡ�Ϊ���ᴿ�Ȼ��أ��Ƚ���Ʒ��������ˮ�У���ֽ������ˣ��ٽ���Һ������ͼ��ʾ������в������ش��������⣺
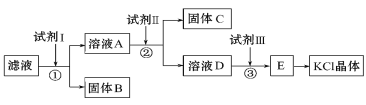
��1���Լ���Ļ�ѧʽΪ_______��
��2���Լ���Ļ�ѧʽΪ_______�����м����Լ����Ŀ���dz�ȥA�е�____������������Ѿ������ķ�����________________________________________________________��
��3�����з�����Ӧ�Ļ�ѧ����ʽΪ_________________________________________________��
��4����E�õ�KCl�����ʵ�������_______________��
���𰸡�BaCl2K2CO3Ba2+���ú�ȡ�����ϲ������Һ���Թ��У��μ�Na2SO4��Һ�����������֣�˵��Ba2+�ѳ���K2CO3+2HCl=CO2��+H2O+2KCl�����ᾧ
��������
�Ȼ�����Ʒ�к�������̼��ء�����غͲ�����ˮ�����ʣ���ȥ̼������Ӻ���������ӣ���Ҫ��������Ȼ�����Һ��Ϊ���ᴿ�Ȼ��أ��Ƚ���Ʒ��������ˮ�У���ֽ������ˣ���ʵ�����̿�֪����Һ�м��Լ�IΪ����BaCl2��Ȼ����˺�B��̼�ᱵ�����ᱵ��A�к��Ȼ������Ȼ��أ��ټ��Լ���Ϊ����K2CO3�����˺�C��Ϊ̼�ᱵ��Ȼ����ˣ�D�к�̼��ء�KCl���ټ����Լ���Ϊ�������ᣬ��ȥ������̼��أ����ͨ������Ũ���������ᾧ�õ�KCl���壬�Դ������
��1���������Ϸ�����֪�Լ������Ȼ�������ѧʽΪBaCl2��
��2���Լ�����̼��أ���ѧʽΪK2CO3��Ŀ���dz�ȥA�е�Ba2+�����鱵�����Ѿ������ķ����Ǿ��ú�ȡ�����ϲ������Һ���Թ��У��μ�Na2SO4��Һ�����������֣�˵��Ba2+�ѳ�����
��3�����м���������Ϊ�˳�ȥ������̼��أ�������Ӧ�Ļ�ѧ����ʽΪK2CO3+2HCl��CO2��+H2O+2KCl��
��4���Ȼ���������ˮ������E�õ�KCl�����ʵ������������ᾧ��


 ������������Ծ�ϵ�д�
������������Ծ�ϵ�д� �������Ӳ�ϵ�д�
�������Ӳ�ϵ�д� ���ɿ��õ�Ԫ����AB��ϵ�д�
���ɿ��õ�Ԫ����AB��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ͼ�������У�����ȷ����
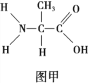


![]()
A. ��ͼ�ͱ�ͼ�ֱ����������Ҫ�е��ߺ��Ŵ���ϢЯ���ߵĻ�����λ
B. ��ͼС��������ɹ�ɹ�������ʧȥ��ˮ������ˮ
C. ����ͼ��aΪ�������ǣ�����b���ɵĺ�����ȫˮ�⣬�õ��Ļ����������5��
D. ��С�����ϸ���ڼ��Ļ����ﶡ�ܿ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Ԫ��H2A��ˮ�еĵ��뷽��ʽ��H2A = H+ + HA����HA��![]() H+ + A2�����ش��������⣺
H+ + A2�����ش��������⣺
��1��Na2A��Һ��______________������ԡ��������ԡ����ԡ�����������________________________________�������ӷ���ʽ���Ҫ������˵������
��2�������£���֪0.1molL��1NaHA��ҺpH=2����0.1molL��1H2A��Һ�������ӵ����ʵ���Ũ�ȿ���______0.11molL��1������ڡ��������ڡ���С�ڡ�����������_____________________��
��3��0.1molL��1NaHA��Һ�и�������Ũ���ɴ�С��˳����_________��
��4��Na2A��Һ�У����б�����ȷ����_________��
A��c��Na+�� + c(H+��= c��HA����+ 2c��A2����+ c��OH����
B. c��OH����= c��HA����+ c��H+��
C��c��OH����= c��HA����+ c��H+��+ 2c��H2A��
D��c (Na+��= 2��c��HA����+ c(A2��) + c(H2A����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ǵ�ͳ�в�ҩ���˵���Ч�ɷ�֮һ��������ϸ����ɱ���ж������á������йغ������ص�������ȷ������ ��
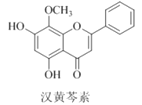
A. �������صķ���ʽΪC16H13O5
B. ������������ԭ��һ������
C. 1 mol����������ˮ��Ӧ���������2 mol Br2
D. ������H2�����ӳɷ�Ӧ�÷����й����ŵ��������1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪Br2��2Fe2��===2Fe3����2Br������100mLFeBr2��Һ��ͨ����������6.72L������ȫ������ԭ�������Һc(Br����=c(Cl������ԭ��Һ��FeBr2��Һ��Ũ��(mol��L��1)Ϊ( )
A. 2 B. 4 C. 2.5 D. 6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����CO2��H2��CO��ɵĻ��������ͬ��ͬѹ���뵪�����ܶ���ͬ����û��������CO2��H2��CO�������Ϊ
A. 29��8��13 B. 22��1��14 C. 13��8��29 D. 44��2��28
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧһ-ѡ��3:���ʽṹ������]��S��Cl ��Fe��Co��Ni �ȹ���Ԫ����ɵ����Ͳ������Ź㷺����;,�ش���������:
(1)��Ԫ�ػ�̬ԭ�ӵĵ����Ų�ʽΪ________��P��S��Cl�ĵ�һ�������ɴ�С˳��Ϊ______��
(2)SCl2 �����е�����ԭ���ӻ����������______���÷��ӿռ乹��Ϊ_______��
(3)Fe��Co��Ni�ȹ���Ԫ������CO�γ������,��ѧʽ��ѭ18���ӹ���:����ԭ�ӵļ۵��������������ṩ�ĵ�����֮�͵���18����Ni ��CO�γ�����ﻯѧʽΪNi(CO)4����Fe��CO�γ�����ﻯѧʽΪ_______��Ni(CO)4�ЦҼ���м�������Ϊ_______��Ni(CO)4Ϊ____�� �塣
(4)��֪NiO�ľ���ṹ��ͼ1��ʾ��

��NiO�ľ���ṹ������Ϊ:��ԭ��λ�����ĺͶ���,��ԭ�ӿ��γ����������϶�����������϶,��ԭ���������ԭ���γɵĿ�϶�С���NiO ��������ԭ���������ԭ���γɵ�______���϶�С�
����֪MgO ��NiO�ľ���ṹ��ͬ,����Mg2+��Ni2+�����Ӱ뾶�ֱ�Ϊ66pm ��69pm�����۵�:MgO_____ NiO( � >������ <" �� =�� ), ������______________��
��һ���¶���,NiO��������Է��ط�ɢ���γɡ������Ӳ㡱,������ΪO2-�����õ�������,Ni2+���O2-�γɵ��������ο�϶��(��ͼ2),��֪O2-�İ뾶Ϊam,ÿƽ��������Ϸ�ɢ��NiO������Ϊ_________g��(��a��NA��ʾ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й� 98%��Ũ�������������������ǣ�
A. �����ˮ�����ʵ�����9��1
B. ���ʵ���Ũ�ȴ���10 mol��L��1
C. ��ˮ�������ϣ�������Һ������������49%
D. ��ˮ��������ϣ�������Һ������������49%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʹ���Ը��������ɫ�������ܸ���ˮ��Ӧ��ɫ���� �� ��
A. �� B. ��ϩ C. �ұ� D. �ѻ�����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com