
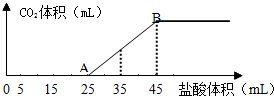
分析 (1)在溶液中碳酸氢钠与氢氧化钠反应生成碳酸钠,结合图象可知,开始没有二氧化碳气体生成,则制成的稀溶液中的溶质为碳酸钠和氢氧化钠,则OA段先发生酸碱中和,再发生碳酸钠与盐酸反应生成碳酸氢钠与氯化钠.
(2)结合图象可知,当加入35mL盐酸时,25~35mL发生碳酸氢钠与盐酸的反应生成二氧化碳气体.
解答 解:(1)在溶液中碳酸氢钠与氢氧化钠反应生成碳酸钠,结合图象可知,开始没有二氧化碳气体生成,则制成的稀溶液中的溶质为碳酸钠和氢氧化钠,则OA段0~5mL先发生酸碱中和,其离子反应方程式为H++OH-═H2O,再发生碳酸钠与盐酸反应生成碳酸氢钠与氯化钠,其离子反应方程式为CO32-+H+═HCO3-,
故答案为:H++OH-═H2O;CO32-+H+═HCO3-;
(2)结合图象可知,当加入35mL盐酸时,25~35mL发生碳酸氢钠与盐酸的反应生成二氧化碳气体,
设生成二氧化碳的物质的量为n,生成气体时消耗的酸的物质的量为(45-25)×10-3L×1mol•L-1=0.02mol,则
HCO3-+H+═CO2↑+H2O
1 1
0.02mol n
则:$\frac{1}{1}=\frac{0.02mol}{n}$,解得:n=0.02mol,标准状况下其体积为:0.02mol×22.4L/mol=0.228L=448mL,
故答案为:448.
点评 本题考查学生利用图象和发生的离子反应来分析解答问题,题目难度中等,明确反应的先后顺序及图象中每段图象对应的化学反应是解答本题的关键,试题培养了学生的化学计算能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
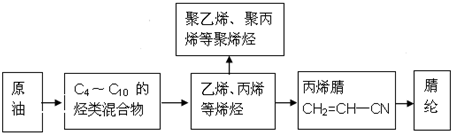
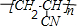 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴有酚酞的氨水中加入少量NH4Cl固体,溶液颜色变浅 | |
| B. | 等浓度的小苏打溶液与烧碱溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) | |
| C. | 向pH=12的NaOH溶液中滴加pH=2的HA溶液达中性:则体积V(HA)≤V(NaOH) | |
| D. | 已知298K时氢氰酸(HCN)的Ka=4.9×10-10、碳酸的Ka1=4.4×10-7,Ka2=4.7×10-11,据此可推测将氢氰酸加入到碳酸钠溶液中能观察到有气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X | B. | Xg | C. | $\frac{X}{{N}_{A}}$g | D. | $\frac{1}{{N}_{A}}$g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的电子式: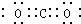 | B. | 乙炔分子的结构式H-C≡C-H | ||
| C. | H2O分子的比例模型  | D. | Clˉ离子的结构示意图: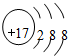 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向沸水中滴加FeCl3饱和溶液可以制备Fe(OH)3胶体 | |
| B. | 用纯碱溶液清洗油污时,加热可以增强其去污能力 | |
| C. | 向纯水中加入稀硫酸或降温都能使水的离子积减小 | |
| D. | 锅炉中沉积的CaSO4可用足量Na2CO3溶液浸泡后,再用稀盐酸溶解掉不溶物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的原子晶体和分子晶体互为同素异形体 | |
| B. | CO2的原子晶体和CO2的分子晶体具有相同的物理性质 | |
| C. | 对于CO2原子晶体,“CO2”是化学式,不是分子式 | |
| D. | CO2原子晶体在一定条件下转化为分子晶体的变化是物理变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com