
��һ��������ܱ������У��������·�Ӧ��A��g�� B��g��+C��g�����仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���ʾ��
| toC | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |

| ʱ��t/min | 0 | 1 | 2 | 4 | 8 | 16 | 20 |
| C��A��/��mol��L��1�� | 10.4 | 8.6 | 7.5 | 6.6 | 5.9 | 5.5 | 5.5 |
��1��c(B)��c(C)/c(A)��2�֣�
��2�� 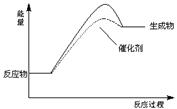 ��3�֣�
��3�֣�
��3���٢ڢޣ�3�֣�
��4����0.45 mol/(L��min)��2�֣� �� 47.1%��2�֣� �������¶Ȼ��СB��C��Ũ�ȣ�2�֣�
���������������2��ʹ�ô�����ܽ��ͣ�����ʼ�������䣻��3�����������ƽ�⣬��������ѹǿ�DZ������䲻�� ��ʾ��Ӧƽ�⣬��ȷ�� ����ϵ��ÿһ�ֳɷֵ������DZ�����c��C�������ʾ��Ӧƽ�⣬��ȷ��
�ۻ��������������䣬����̶����ʻ��������ܶ��Ǻ��������ܷ�Ӧ����Ӧ�����淴Ӧ������ȣ�v��A��=v��B��ֻ�DZ�ʾ���������¶�һ������ѧƽ�ⳣ��K���� ������ �������ƽ��ʽ������������ʵ����ɷ��ȣ��DZ�������ȷ����4�����ݹ�ʽֱ�Ӽ����0.45 mol/(L��min) �� 47.1%���������A��ƽ��ת���ʣ���ʹ���Բ�ȡ�Ĵ�ʩ�������¶Ȼ��СB��C��Ũ�Ȼ��Сѹǿ��
���㣺���黯ѧƽ���뷴Ӧ�����й����⡣


 �����ҵ��ٿ���������������ϵ�д�
�����ҵ��ٿ���������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�����û�ѧ��Ӧԭ�������֪ʶ�о�̼���仯��������ʡ�
��1����ҵ��һ����CO��H2Ϊԭ�Ϻϳɼ״����ں��������У��÷�Ӧ���Ȼ�ѧ����ʽΪ��
CO(g)��2H2(g)  CH3OH(g)����H1����116 kJ��mol��1
CH3OH(g)����H1����116 kJ��mol��1
�����д�ʩ����˵����Ӧ�ﵽƽ��״̬����___________
| A����ϵѹǿ���ֲ��� |
| B�����������ܶȱ��ֲ��� |
| C��CO��H2��Ũ��֮��Ϊ1��2 |
| D����λʱ���ڣ�����2molH2��ͬʱ����1mol CH3OH |
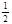 O2(g)=CO2(g) ��H2����283 kJ��mol-1 H2(g)+
O2(g)=CO2(g) ��H2����283 kJ��mol-1 H2(g)+ 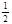 O2(g)=H2O(g) ��H3����242 kJ��mol-1
O2(g)=H2O(g) ��H3����242 kJ��mol-1�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�ϳɰ���ũҵ���������������������Ҫ���塣
N2(g)+3H2(g) 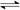 2NH3(g) ��H = -92 kJ��mol-1
2NH3(g) ��H = -92 kJ��mol-1
��1���ں��º����ܱ������н��еĺϳɰ���Ӧ�������ܱ�ʾ�ﵽƽ��״̬����_______
a����������ѹǿ���ٷ����仯
b�����������ܶȲ��ٷ����仯
c����Ӧ������N2��NH3�����ʵ����ı�ֵ���ٷ����仯
d����λʱ���ڶϿ�a��H-H����ͬʱ�γ�3 a��N-H��
e���������ʵ�Ũ�ȱ�ǡ�õ��ڻ�ѧ����ʽ�и����ʵĻ�ѧ������֮��
��2���ں��º��ݵ��ܱ������У��ϳɰ���Ӧ�ĸ�����Ũ�ȱ仯��������ͼ��ʾ����ش��������⣺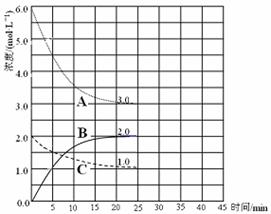
�� ��ʾN2��Ũ�ȱ仯�������� ��ѡ�����ߴ��š�A������B����C������
�� ǰ25 min �ڣ���H2��Ũ�ȱ仯��ʾ�Ļ�ѧ��Ӧƽ�������� ��
����25 min ĩ��Ӧ�պôﵽƽ�⣬����¶��·�Ӧ��ƽ�ⳣ��K = �����������÷�����ʾ�����������¶ȣ��÷�Ӧ��ƽ�ⳣ��ֵ��___ ____(���������С�����䡱)��
��3���ڵ�25 min ĩ�����������������䣬�����߷�Ӧ�¶Ȳ��跨���ָ��¶Ȳ��䣬�ڵ�35 minĩ�ٴδﵽƽ�⡣ƽ���ƶ�������H2Ũ�ȱ仯��1.5 mol��L-1��������ͼ�л�����25 min �� 40 min NH3Ũ�ȱ仯���ߡ�
��4����һ���¶��£���1 mol N2��3 mol H2����������������ܱ������з�����Ӧ���ﵽƽ��״̬ʱ��������������ʵ���Ϊ2.8 mol ��
�ٴ�ƽ��ʱ��H2��ת���ʦ�1 = ______ ______��
������ͬ�����£�����ʼʱֻ��NH3���ڸ������У��ﵽƽ��״̬ʱNH3��ת����Ϊ��2������1 + ��2 =1ʱ������ʼʱn (NH3)= ___ _____mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�ϳɰ������Ĵ����������˹��̵�����Ҫ;�������о�������ȷ������ָ�����ϳɰ���Ӧ��ƽ�ⳣ��Kֵ���¶ȵĹ�ϵ���£�
| �� �ȣ��棩 | 360 | 440 | 520 |
| Kֵ | 0.036 | 0.010 | 0.0038 |
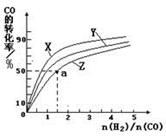
 CO(g)+3H2(g) ��ȡ����֪�÷�Ӧ�У�����ʼ�����
CO(g)+3H2(g) ��ȡ����֪�÷�Ӧ�У�����ʼ�����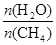 �㶨ʱ���¶ȡ�ѹǿ��ƽ������CH4������Ӱ������ͼ��ʾ��
�㶨ʱ���¶ȡ�ѹǿ��ƽ������CH4������Ӱ������ͼ��ʾ��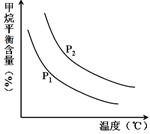
 CO2 (g)+H2(g) ��ȡ��
CO2 (g)+H2(g) ��ȡ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�о�NOx�����������SO2��CO�ȴ�����Ⱦ����IJ���������������Ҫ���塣
��1����ͼ�� ��Ӧ����������ʾ��ͼ��
��Ӧ����������ʾ��ͼ��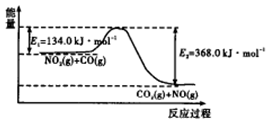
�÷�Ӧ���ʱ�
��2��һ�������£�ͨ��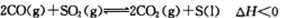 ����ʵ��ȼú��������Ļ��ա�ij�о�С����2Lij�ܱյ������������������������䣬��������������Բ��ƣ���ͨ��CO��SO2��10���Ӻ�������CO2�����ʵ���Ϊ0.9mol��
����ʵ��ȼú��������Ļ��ա�ij�о�С����2Lij�ܱյ������������������������䣬��������������Բ��ƣ���ͨ��CO��SO2��10���Ӻ�������CO2�����ʵ���Ϊ0.9mol��
������v(CO2)��ʾ�ķ�Ӧ����Ϊ ��
�ڸ÷�Ӧ��ƽ�ⳣ���ı���ʽΪ��K= ��
������ӿ�����Ӧ���ʵ�ͬʱ���SO2��ת���ʣ����Բ��õķ����� ��
��3����ҵ�ϳ���Na2CO3��Һ���շ����������������NO��NO2�Ļ����Ϊ������
��֪��NO������Na2CO3��Һ��Ӧ��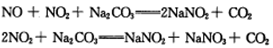
����������Na2CO3��Һ��ȫ����NO��NO2�Ļ���ÿ����22.4L����״����CO2��ȫ���ݳ���ʱ������Һ����������44g������������NO��NO2�������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�ҹ��зḻ����Ȼ����Դ������Ȼ��Ϊԭ�Ϻϳ����ص���Ҫ��������ͼ��ʾ��ͼ��ijЩת�����輰������δ�г�����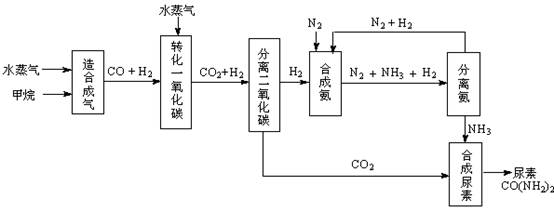
��1������ϳ������������Ȼ�ѧ����ʽ��CH4(g)+H2O(g)  CO(g)+3H2(g)����H��0
CO(g)+3H2(g)����H��0
�ں��º��ݵ������£������CH4�ķ�Ӧ���ʺ�ת���ʣ����д�ʩ���е��� ��
A������ѹǿ B�������¶� C������He�� D������ˮ����Ũ��
��2����ת��һ����̼�������ķ���ʽ��H2O(g) +CO(g)  H2(g)+CO2(g)���÷�Ӧƽ�ⳣ�����¶ȵı仯���£�
H2(g)+CO2(g)���÷�Ӧƽ�ⳣ�����¶ȵı仯���£�
| �¶�/�� | 400 | 500 | 800 |
| ƽ�ⳣ��K | 9.94 | 9 | 1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ѧѧ���е�ƽ��������Ҫ��������ѧƽ�⡢����ƽ�⡢ˮ��ƽ����ܽ�ƽ�����֣��Ҿ�������������ԭ������ش��������⣺
��1�������£�ȡ pH=2������ʹ�����Һ��100mL, �����зֱ����������Zn������Ӧ����������Һ��pH�仯��ͼ��ʾ����ͼ�б�ʾ������Һ��pH�仯���ߵ��� ( �A����B��)�� �������м����Zn����Ϊm1��������Һ�м����Zn����Ϊ m2�� �� m1 m2 ( ѡ�<������=������>��)
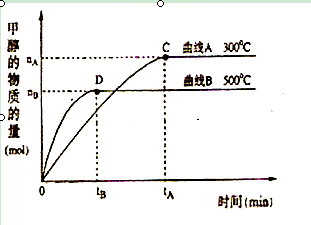
��2�������Ϊ3L���ܱ������У�CO��H2��һ�������·�Ӧ���ɼ״���CO ( g) + 2H2( g) �� CH3OH(g) ����Ӧ�ﵽƽ��ʱ��ƽ�ⳣ������ʽK= �������¶ȣ�Kֵ (���������С�����䡱)����500�棬�ӷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ����v(H2)=
��3�������£�ij������Һ�е����̪����Һ�ʺ�ɫ��˵������Һ�� �ԡ��ڷ�������Һ����̪�ʺ�ɫԭ��ʱ����ͬѧ��Ϊ��������Һ���õĴ�����Ʒ�л���NaOH ���£���ͬѧ��Ϊ����Һ��Na2CO3�������CO32-ˮ�����¡��������һ����ʵ�鷽����������λͬѧ��˵��������(��������������ͽ���) ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
һ���¶��£���1.0L�ܱ������м���0.60molX(g)��������ӦX(g)  Y(s)+2Z(g)��H��0��÷�Ӧ��XŨ���뷴Ӧʱ����������±�
Y(s)+2Z(g)��H��0��÷�Ӧ��XŨ���뷴Ӧʱ����������±�
| ��Ӧʱ��t/min | 0 | 1 | 2 | 3 | 4 | 6 | 8 |
| c(X)/(mol��L-1) | 0.60 | 0.42 | 0.30 | 0.21 | 0.15 | a | 0.0375 |
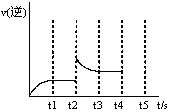
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
��16�֣���.������Ϣ��ҵ��̫���ܵ�ع��ת���Ļ������ϡ�п��ԭ���Ȼ�����һ����������Ӧ��ǰ�����Ʊ���ķ��������Ʊ�����ʾ��ͼ���£�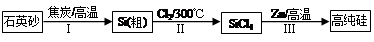
��1����̿�ڹ��̢����� ����
��2�����̢���Cl2�õ�ⱥ��ʳ��ˮ�Ʊ����Ʊ�Cl2�Ļ�ѧ����ʽΪ ��
��3�������������̱����ϸ������ˮ��
��SiCl4��ˮ����ˮ������SiO2��һ���ᣬ��Ӧ����ʽΪ ��
�ڸ���Cl2ʱ�������ڳ�ָ���Ͳ�����ȫ�ĽǶȿ��ǣ��轫Լ90��ij�ʪ��������ȴ��12�棬Ȼ����ͨ��ŨH2SO4�С���ȴ�������� ��
��4��Zn��ԭSiCl4�ķ�Ӧ���£�
��Ӧ�٣�400�桫756�棬SiCl4(g)+2Zn(l) Si(S)+2ZnCl2(l) ��H1��0
Si(S)+2ZnCl2(l) ��H1��0
��Ӧ�ڣ�756�桫907�棬SiCl4(g)+2Zn(l) Si(S)+2ZnCl2(g) ��H2��0
Si(S)+2ZnCl2(g) ��H2��0
��Ӧ�ۣ�907�桫1410�棬SiCl4(g)+2Zn(g) Si(S)+2ZnCl2(g) ��H3��0
Si(S)+2ZnCl2(g) ��H3��0
i. ��Ӧ�ڵ�ƽ�ⳣ������ʽΪ ��
ii. ��������������Ӧ������˵���������� ��
a.�����¶Ȼ����SiCl4��ת���� b.��ԭ�������������������н���
c.����ѹǿ����߷�Ӧ���� d.Na��Mg���Դ���Zn��ԭSiCl4
��5���ù�����̫���ܵ��ʱ��Ϊ�������ڹ����ķ��䣬���û�ѧ��ʴ����������γɴֲڵĶ��㡣��ʴ������ϡHNO3��HF�Ļ��Һ������������γ�SiO2�����ת����H2SiF6���û�ѧ����ʽ��ʾSiO2ת��ΪH2SiF6�Ĺ��� ��
��.��1�����顢������һ����̼��ȼ���ȷֱ�ΪakJ��mol��1��bkJ��mol��1��ckJ��mol��1����ҵ��������ȼ���Ͷ�����̼��Ӧ�Ʊ��ϳ�����CO��H2�������Ȼ�ѧ��Ӧ����ʽΪ ��
��2����֪Ksp(AgCl)��1.8��10��10��Ksp(AgI)��1.5��10��16��Ksp(Ag2CrO4)��2.0��10��12�����������εı�����Һ�У�Ag+Ũ�ȴ�С��˳��Ϊ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com