
| A. | Li是最活泼金属,F是最活泼非金属 | |
| B. | Mg(OH)2碱性比Ca(OH)2强 | |
| C. | X2+的核外电子数目为18,则X在第三周期第ⅡA族 | |
| D. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16族 |
分析 A.同一周期元素,随着原子序数增大,其金属性逐渐减弱、非金属性逐渐增强,同一主族元素,其金属性随着原子序数增大而增强,非金属性随着原子序数增大而减弱;
B.金属性越强,则对应的最高价氧化物的水合物的碱性越强;
C.原子结构示意图中,电子层数与其周期数相等,主族元素最外层电子数与其族序数相等,根据阳离子的核外电子数=质子数-电荷数,在原子中,原子序数=质子数=核外电子数,X2+的核外电子数目为18,则X质子数为20;
D.元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共18纵行、16族.
解答 解:A.同一周期元素,随着原子序数增大,其金属性逐渐减弱,同一主族元素,其金属性随着原子序数增大而增强,所以最活泼金属是Fr,同一周期元素,随着原子序数增大,其非金属性逐渐增强,同一主族元素,其非金属性随着原子序数增大而减弱,所以F是最活泼非金属,故A错误;
B.金属性Ca>Mg,元素的金属性越强,对应的最高价氧化物的碱性越强,Mg(OH)2碱性比Ca(OH)2弱,故B错误;
C.根据阳离子的核外电子数=质子数-电荷数,X2+的核外电子数目为18,则X质子数为20,在原子中,原子序数=质子数=核外电子数,所以X核外电子数为20,原子结构示意图为: ,原子结构示意图中,电子层数与其周期数相等,主族元素最外层电子数与其族序数相等,则X在第四周期第ⅡA族,故C错误;
,原子结构示意图中,电子层数与其周期数相等,主族元素最外层电子数与其族序数相等,则X在第四周期第ⅡA族,故C错误;
D.在元素周期表中有7个周期、7个主族、7个副族、1个0族、1个第VIII族,共有7个横行,共18纵行、16族,故D正确;
故选D.
点评 本题考查了元素周期表及元素周期律的应用,明确元素周期表结构及元素周期律内涵即可解答,知道同一周期、同一主族元素性质的递变性,注意离子核外电子数、质子数、电荷数之间的关系,题目难度不大.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 64gSO2含有硫原子数为2NA | |
| B. | NA个氧分子和NA个氢分子的质量比等于16:1 | |
| C. | 28g氮气所含的原子数目为NA | |
| D. | 标准状况下,22.4L的水含有 NA个水分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
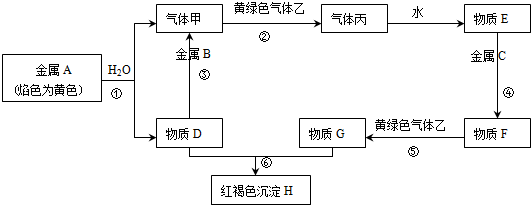
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、Al3+、Cl-、OH- | B. | Na+、Ba2+、OH-、SO42- | ||
| C. | K+、Na+、NO3-、HCO3- | D. | K+、NH4+、CO32-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.087 | B. | 0.174 | C. | 0.06 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com