
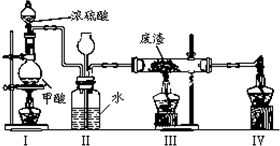
| A. | 挥发 | B. | 电解 | C. | 萃取 | D. | 蒸馏 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 溶液的质量分数为7.8% | B. | 溶液中溶质的质量大于7.8g | ||
| C. | 溶液中水的质量等于92.2g | D. | 溶液的质量等于100g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 南海某小岛上,可利用的淡水资源相当匮乏,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示山泉水属于硬水.
南海某小岛上,可利用的淡水资源相当匮乏,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示山泉水属于硬水.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
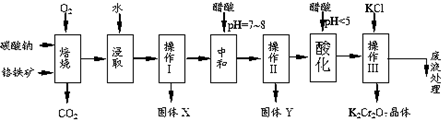
| 物质 | 溶解度/(g/100g水) | ||
| 0°C | 40°C | 80°C | |
| KCl | 28 | 40.1 | 51.3 |
| NaCl | 35.7 | 36.4 | 38 |
| K2Cr2O7 | 4.7 | 26.3 | 73 |
| Na2Cr2O7 | 163 | 215 | 376 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在此反应中,O2氧化剂,PtF6是还原剂 | |
| B. | O2(PtF6)中氧元素的化合价为+1价 | |
| C. | 在此反应中,每生成1 mol O2(PtF6) 则转移1 mol电子 | |
| D. | 在O2(PtF6)中不存在共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com