
�������ƣ�NaNO2����һ�ֳ�����ʳƷ���Ӽ���ʹ��ʱ�����ϸ������������ij��ȤС���������ʵ��̽������������֪������2NO+Na2O2=2NaNO2 ��2NO2+Na2O2=2NaNO3������KMnO4��Һ�ɽ�NO2������ΪNO3����MnO4����ԭ��Mn2+��
��Ʒ�Ʊ�����飺����ͼ1װ���Ʊ�NaNO2��
��1��д��װ��A��ƿ�з�����Ӧ�Ļ�ѧ����ʽ���������ת�Ƶķ������Ŀ__________
��2��Bװ�õ�������_______
��3����ͬѧ��Ϊװ��C�в��ﲻ�����������ƣ����������ơ�̼���ơ��������ƣ�Ϊ�Ʊ�����NaNO2Ӧ��B��Cװ�ü�����һ��װ�ã������ҿ��ڻ������ӵ�װ��ͼ2��������ʢ�ŵ��Լ���
��4�������ʵ�����װ��C��NaNO2�Ĵ��ڣ�д������������ͽ��ۣ�_____________________
�����IJⶨ
��ȡװ��C�з�Ӧ��Ĺ���4.00g����ˮ���250mL��Һ��ȡ25.00mL��Һ����ƿ�У���0.1000mol/L����KMnO4��Һ���еζ���ʵ�������������±���ʾ��

��5����һ��ʵ�����ݳ� ���쳣����������쳣��ԭ�������________��˫��ѡ��
���쳣����������쳣��ԭ�������________��˫��ѡ��
A����ʽ�ζ���������ˮϴ����δ�ñ�Һ��ϴ
B����ƿϴ����δ����
C���ζ��������Ӷ���
D���ζ��������Ӷ���
��6�����ݱ������ݣ��������ù������������Ƶ���������________���������4λ��Ч���֣�
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��������������һ�и߶��µڶ����¿���ѧ���������棩 ���ͣ�ѡ����
��ѧʽΪC 4H8O3���л����Ũ������ںͼ���ʱ�����������ʣ�
4H8O3���л����Ũ������ںͼ���ʱ�����������ʣ�
���ֱܷ���CH3CH2OH��CH3COOH��Ӧ������ˮ����һ����ʹ��ˮ��ɫ�����ʣ�������ֻ����һ�ֽṹ��ʽ����������һ�ַ���ʽΪC4H6O2����Ԫ��״�������C4H8O3�Ľṹ��ʽΪ�� ��
A��HOCH2COOCH2CH3 B��CH3CH��OH��CH2COOH
C��CH3CH2CH��OH��COOH D��HOCH2CH2CH2COOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�캣��ʡ����ȫ��ģ�����ѧ�Ծ��������棩 ���ͣ�ѡ����
�������������ŵ�ش�ijЩ����������ȡ�������װ��, ����˵������ȷ����
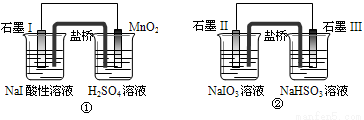
A������װ����ʯīI��ʯīII������
B����Ԫ����װ�â��б���������װ�â��б���ԭ
C������MnO2�ĵ缫��ӦʽΪ��MnO2+2H2O+2e-==Mn2++4OH‑
D����Ӧ�١��������ɵ�����I2ʱ������ͨ���ĵ�����֮��Ϊ1��5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�����ʡ����ʮ��ģ���ƻ�ѧ�Ծ��������棩 ���ͣ�ʵ����
�ҹ�����ר�Һ�°�ġ������Ƽ����Ϊ�����Ƽҵ������ͻ�����ס�����NaCl��NH3 ��CO2��Ϊԭ�����Ƶ�NaHCO3����������������йط�Ӧ�Ļ�ѧ����ʽΪ��NH3 + CO2 + H2O = NH4HCO3 �� NH4HCO3 + NaCl = NaHCO3��+ NH4Cl �� 2NaHCO3 = Na2CO3 + CO2��+ H2O
��1��̼������뱥��ʳ��ˮ��Ӧ��������̼�����ƾ����ԭ���� �����ţ���
A��̼������������ˮ B��̼�����������ֽ�
C��̼�����Ƶ��ܽ����Խ�С����������Һ�����Ƚᾧ����
��2��ij̽���С����������Ƽ�ԭ��������̼�����Ƶ��Ʊ�ʵ�飬ͬѧ�ǰ�������Ƶķ���ʵ�顣
�� һλͬѧ��������̼����ͨ�뺬���ı���ʳ��ˮ���Ʊ�̼�����ƣ�ʵ��װ������ͼ��ʾ��ͼ�мг֡��̶��õ�����δ��������

�Իش������й����⣺
 ������װ���е��Լ��� ��
������װ���е��Լ��� ��
����װ����ϡ����������� ��
����ʵ����������NaHCO3 ����IJ����� ���������������ƣ���
�� ��һλͬѧ��ͼ����װ�ã�����װ��δ����������ʵ�顣
����ʵ��ʱ�����ȴ� ��ͨ�� ���壬�ٴ� ����ͨ�� ���塣
������ͬѧ��������װ�õ�b���¶����Ӽ�װ�ã������� .
��3��������д��һ��ʵ������ȡ����̼�����Ƶķ����� .
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�����ʡ����ʮ��ģ���ƻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ѧ��Դ������Ҳ������������й��������еĻ�ѧ������ȷ���ǣ� ��
A��ú�ĸ����ú��Һ�����������仯��
B���û���̿Ϊ������ɫ���ó���Ư��ֽ��ԭ�����ơ�
C������������ϸСҺ���������ɢ���������γɵ�һ�����ܽ���
D�����ά����Ϣ����Ӧ��Խ��Խ�㷺�����ά����Ҫ�ɷ���Si���ʡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�����������·һ�и���5���¿����ƻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
����ʵ���У���Ӧ�������Լ����۶���ȷ�����߾��������ϵ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016���������ʦ���и����µ����������ƻ�ѧ�Ծ��������棩 ���ͣ�ʵ����
�ױ��� ����һ����Ҫ�Ļ���ԭ�ϣ���������������ȩ��
����һ����Ҫ�Ļ���ԭ�ϣ���������������ȩ�� ���������ᣨ
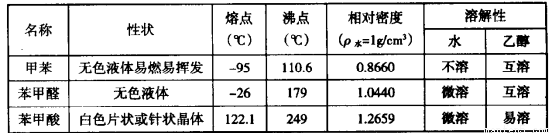
���������ᣨ ���Ȳ�Ʒ���±��г����й����ʵIJ����������ʣ���ش�
���Ȳ�Ʒ���±��г����й����ʵIJ����������ʣ���ش�
ע���ױ�������ȩ�������������ܣ� ���ԣ� ���������
ʵ���ҿ�����ͼװ��ģ���Ʊ�����ȩ��ʵ��ʱ��������ƿ�м���0��5g��̬�����Դ������ټ���15mL�������2mL�ױ�������������70�棬ͬʱ��������12mL�������⣬�ڴ��¶��½��跴Ӧ3Сʱ��

��1��װ��a��������____ ____����Ҫ������ ������ƿ�з�����Ӧ�Ļ�ѧ����ʽΪ ���˷�Ӧ��ԭ�������������Ͽɴ� ��
��2�����ⶨ����Ӧ�¶�����ʱ���ױ���ת�����������¶ȹ���ʱ������ȩ�IJ���ȴ�������٣����ܵ�ԭ����________________��
��3����Ӧ��Ϻ�Ӧ���Һ������Ȼ��ȴ������ʱ����Ӧ����________��________����������ƣ��Ȳ��������ܵõ�����ȩ�ֲ�Ʒ��
��4��ʵ���м�������Ĺ������Ⲣ�ӳ���Ӧʱ��ʱ����ʹ����ȩ��Ʒ�в����϶�ı����ᡣ
������ӻ��б�����ı���ȩ�з���������ᣬ��ȷ�IJ���������_______��������˳������ĸ����
a���Ի��Һ���з�Һ b�����ˡ�ϴ�ӡ�����
c��ˮ���м����������pH��2 d��������̼��������Һ�����
������ʵ����л�õı������Ʒ���д��Ȳⶨ���ɳ�ȡ1.200g��Ʒ������100mL�Ҵ������Һ����ȡ���õ��Ҵ���Һ20��00mL����ƿ���μ�2��3�η�ָ̪ʾ����Ȼ����Ԥ����õ�0.1000mol/L KOH��Һ�ζ�������ζ��յ�ʱ����KOH��Һ18��00mL����Ʒ�б��������������Ϊ________��
�����������ʹ�ⶨ���ƫ�͵���__________������ĸ����
a���ζ��յ�ʱ���Ӷ�ȡ�ļ��� b��KOH��Һ��ʱ��Ӵ�����
c������KOH��Һʱ���Ӷ��� d������ָ̪ʾ����Ϊ������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��ӱ�������ѧ��һ�µڶ����¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��һ���¶��µĺ����ܱ������У�������Щ���������ٷ����仯ʱ������������Ӧ��A��s��+2B��g��?C��g��+D��g���Ѵﵽƽ��״̬
�ٻ�������ѹǿ
�ڻ��������ܶ�
��B�����ʵ���Ũ��
������������ʵ���
�ݻ�������ƽ����Է�������
������C�İٷֺ���
�߸���������ʵ���
A���ڢۢݢޢ� B���٢ڢۢޢ� C���ڢۢܢݢ� D���٢ۢܢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꽭��ʡ��һ�µڶ����¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
һ���¶��£���2 L���ܱ������У�X��Y��Z������������ʵ�����ʱ��仯��������ͼ��ʾ��������ȷ����( )
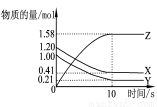
A����Ӧ��ʼ��10 s,��Z��ʾ�ķ�Ӧ����Ϊ0.158 mo l/(L��s)
l/(L��s)
B����Ӧ��ʼ��10 s,X�����ʵ���Ũ�ȼ� ����0.79 mol/L
����0.79 mol/L
C����Ӧ��ʼ ��10 sʱ��Y��ת����Ϊ79.0%
��10 sʱ��Y��ת����Ϊ79.0%
D����Ӧ�Ļ�ѧ����ʽΪ��X(g)+Y(g) Z(g)
Z(g)
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com