
| A. | Ca(ClO)2 | B. | CaCl2 | C. | CaCO3 | D. | Ca(OH)2 |
科目:高中化学 来源: 题型:选择题
| A. | 原子半径逐渐增大 | |
| B. | 单质氧化性逐渐增强 | |
| C. | 气态氢化物的稳定性逐渐增强 | |
| D. | 都有最高价氧化物的水化物,化学式为HXO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 反应时间/min | n(X)/mol | n(Y)/mol |
| 0 | 2.00 | 2.40 |
| 10 | 1.00 | |
| 30 | 0.40 |
| A. | 前10 min内反应的平均速率为v(Z)=0.10 mol•L-1•min-1 | |
| B. | 温度为200℃时,上述反应平衡常数为20,则正反应为吸热反应 | |
| C. | 若密闭容器体积可变,其他条件不变,在达到平衡后缩小容器体积为原来一半,则c(X)<1mol/L | |
| D. | 保持其他条件不变,向容器中再充入1.00 mol X气体和1.20 mol Y气体,到达平衡后,X转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:Y>W | |
| B. | 上述四种元素的单质中只有2种能导电 | |
| C. | X与Z两者的最高价氧化物的组成和结构相似 | |
| D. | 在加热条件下,Y的单质可溶于W的最高价含氧酸的浓溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将少量Fe(NO3)2加水溶解后,滴加稀硫酸酸化,再滴加KSCN溶液 | 溶液变成血红色 | Fe(NO3)2已变质 |
| B | 在KI溶液中滴加少量氯水,再加入CCl4,充分震荡. | 液体分层,下层溶液呈紫红色. | 氯的非金属性比碘强 |
| C | 炭粉中加入浓硫酸并加热,导出的气体通入BaCl2溶液中 | 有白色沉淀产生 | 有SO2和CO2产生 |
| D | 向AgNO3溶液中滴加少量NaCl溶液,然后再向其中滴加KI溶液 | 先生成白色沉淀,后生成黄色沉淀 | 溶解度:AgCl>AgI |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
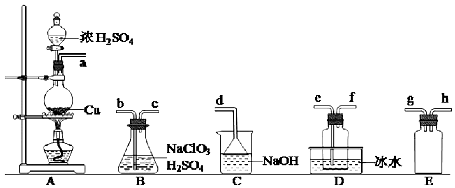
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com