
分析 (1)碳酸钠与盐酸反应生成二氧化碳气体,氯化钠与盐酸不反应;
(2)碳酸氢钠与盐酸反应生成氯化钠、水和二氧化碳;
(3)碳酸氢钠不稳定受热分解生成碳酸钠和水、二氧化碳.
解答 解:(1)碳酸钠与盐酸反应生成二氧化碳气体,氯化钠与盐酸不反应,反应离子方程式:CO32-+2H+=CO2↑+H2O;所以可以用稀盐酸鉴别氯化钠与碳酸钠溶液;
故答案为:稀盐酸、CO32-+2H+=CO2↑+H2O;
(2)碳酸氢钠与盐酸反应生成氯化钠、水和二氧化碳,反应的离子方程式:HCO3-+H+=CO2↑+H2O;所以可以用稀盐酸除去氯化钠中少量的碳酸氢钠;
故答案为:稀盐酸、HCO3-+H+=CO2↑+H2O;
(3)碳酸氢钠不稳定受热分解生成碳酸钠和水、二氧化碳,化学方程式:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;故用加热方法可以除去碳酸钠中的碳酸氢钠;
故答案为:加热、2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
点评 本题考查了物质的鉴别与除杂,侧重离子方程式、化学方程式的书写,明确物质的性质及发生反应的实质即可解答,注意除杂时不能引入新的杂质.


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 四氯化碳的电子式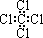 | B. | 环丙烷的最简式CH2 | ||
| C. | 甲醛的结构式HCHO | D. | S2-的最外层电子排布式3s23p4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
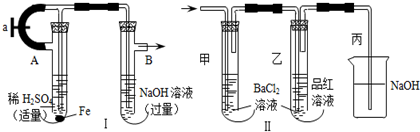
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a×b×18×6.02×1023 | B. | $\frac{18b}{a}$×6.02×1023 | ||
| C. | $\frac{18a}{b}$×6.02×1023 | D. | $\frac{b}{18a}$×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
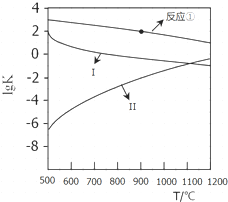 用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应.
用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
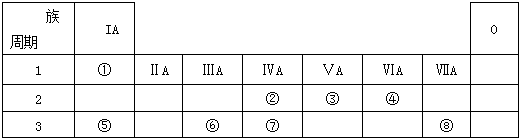
 .
.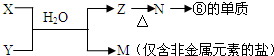
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com