
分析 根据M=ρVm计算出该混合气体的平均摩尔质量,然后设出二者的物质的量,根据平均摩尔质量列式计算二者物质的量之比,相同条件下气体体积之比等于其物质的量之比,从而得出该气体中氧气和甲烷的体积比.
解答 解:在标准状况时,该气体的密度为1.00g/L,则混合气体的平均摩尔质量为:1.00g/L×22.4L/mol=22.4g/mol,
设混合气体中氧气、甲烷的物质的量分别为xmol、ymol,
则:$\frac{32x+y}{x+y}$=22.4,
整理可得x:y=2:3,
相同条件下气体体积之比等于其物质的量之比,所以该气体中氧气和甲烷的体积比为2:3,
答:该气体中氧气和甲烷的体积比为2:3.
点评 本题考查了物质的量的有关计算,题目难度不大,明确气体密度与摩尔质量之间的关系为解答关键,注意掌握平均值法在化学计算中的应用,试题培养了学生的化学计算能力.


 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案科目:高中化学 来源: 题型:选择题
| A. | ②和③ | B. | ②和① | C. | ③和① | D. | ④和① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加Fe(s)的量 | B. | 将容器的体积缩小一半 | ||
| C. | 升高温度 | D. | 通入水蒸气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
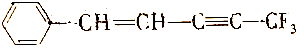 ,下列说法中不正确的是( )
,下列说法中不正确的是( )| A. | 共平面的原子最多有19个 | B. | 共平面的原子至少有10个 | ||
| C. | 共平面的碳原子最多有11个 | D. | 共直线的碳原子最多有4个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
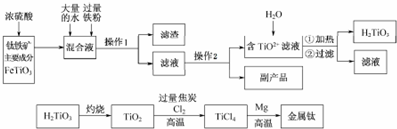
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com