
 =0.2mol,所以Na2CO3与NaHCO3的平均摩尔质量为
=0.2mol,所以Na2CO3与NaHCO3的平均摩尔质量为 =95g/mol,根据十字交叉法计算Na2CO3与NaHCO3的各自物质的量,
=95g/mol,根据十字交叉法计算Na2CO3与NaHCO3的各自物质的量,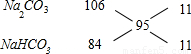
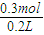 =1.5mol/L.
=1.5mol/L.

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源:辽宁省大连二十四中2012届高三上学期期中考试化学试题 题型:022
储氢纳米碳管的研制成功体现了科技的进步.用电弧法合成的纳米碳管常伴有大量的杂质碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,反应中的反应物和生成物有C、CO2、H2SO4、KCr2O7、Cr2(SO4)2、H2O七种物质.
(1)若将碳纳米颗粒分散到一定溶剂中,形成稳定的分散系,所具的性质有________.
①丁达尔效应
②加入饱和(NH4)2SO4溶液产生聚沉
③可通过半透膜
(2)请用上述物质填空,配平化学方程式,并标出电子转移的方向和数目________C+________+________H2SO4→________K2SO4+________+________Cr2(SO4)3+________H2O
(3)将标准状况下4.48 L产生的气体通入适量的NaOH溶液中充分反应后,溶液中生成盐的质量为19.0 g.
(Ⅰ)若要使生成的盐的质量变为25.2 g,则应继续向溶液中通入该气体________g.
(Ⅱ)向生成的19.0 g的盐溶液中加入一定量某物质,充分反应后,减压低温蒸发得到纯净的21.2 g Na2CO3固体.则:
①若只能加入0.05 mol某物质,则加入的物质可以是________或________.
②若只能加入0.10 mol某物质,则加入的物质可以是________或________.
查看答案和解析>>
科目:高中化学 来源:江西省白鹭洲中学2012届高三第一次月考化学试题 题型:058
将标准状况下4.48 L的CO2通入适量的NaOH溶液中充分反应后,溶液中生成盐的质量为19.0 g.
(1)若要使生成的盐的质量变为25.2 g,则应继续向溶液中通入CO2________g.(写出计算过程)
(2)向生成的19.0 g的盐溶液中加入一定量某物质,充分反应后,减压低温蒸发得到纯净的21.2 g Na2CO3固体.则:
①若只能加入0.05 mol某物质,则加入的物质可以是________或________.
②若只能加入0.10 mol某物质,则加入的物质可以是________或________.
查看答案和解析>>
科目:高中化学 来源: 题型:
A.3.8 g B.5.6 g C.4.8 g D.6.0 g
查看答案和解析>>
科目:高中化学 来源: 题型:
将标准状况下4.48 L的CO2通入适量的NaOH溶液充分反应后,溶液中生成盐的质量为19.0 g。
(1)若要使生成的盐的质量变为25.2 g,应继续向溶液中通入标准状况下CO2 g。
(2)向生成的19.0 g的盐溶液中加入一定量某物质,充分反应后,减压低温蒸发得到纯净的21.2 g Na2CO3固体。则:
①若只能加入0.05 mol某物质,则加入的物质可以是 或 。
②若只能加入0.10 mol某物质,则加入的物质可以是 或 。
查看答案和解析>>
科目:高中化学 来源: 题型:
将标准状况下4.48 L的CO2通入适量的NaOH溶液充分反应后,溶液中生成盐的质量为19.0 g。
(1)若要使生成的盐的质量变为25.2 g,应继续向溶液中通入标准状况下CO2 g。
(2)向生成的19.0 g的盐溶液中加入一定量某物质,充分反应后,减压低温蒸发得到纯净的21.2 g Na2CO3固体。则:
①若只能加入0.05 mol某物质,则加入的物质可以是 或 。
②若只能加入0.10 mol某物质,则加入的物质可以是 或 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com