
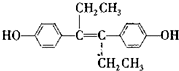
 )是一种激素类药物,下列说法正确的是( )
)是一种激素类药物,下列说法正确的是( )| A. | R是芳香烃 | B. | R含2种含氧官能团 | ||
| C. | 1 mol R最多与1 mol H2加成 | D. | R能发生加成、取代和氧化反应 |
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:解答题
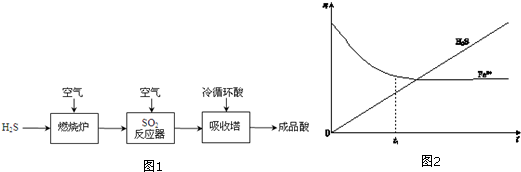
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCO(g)完全燃烧生成CO2(g)放出热量283J | |
| B. | 1molCO(g)完全燃烧比1molC(s)完全燃烧放出的热量多 | |
| C. | 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2 (g)△H<-452kJ/mol | |
| D. | 当Na2O2(s)与CO2(g)反应生成Na2CO3(s)和O2 (g)放出452kJ热量时,转移的电子数为2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PbCO3 | B. | 2PbCO3•Pb(OH)2 | C. | Pb(OH)2 | D. | (CH3COO)2Pb |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蔗糖在人体内水解的最终产物是葡萄糖 | |
| B. | 蔬菜水果属于碱性食物,对人体健康有益 | |
| C. | 为了防止蛋白质发生盐析,疫苗等生物制剂要冷藏 | |
| D. | 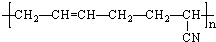 由CH2=CH2与CH2=CH-CN加聚而成 由CH2=CH2与CH2=CH-CN加聚而成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
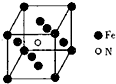 氮、硫、氯、钠、铝、铁及其化合物是研究基本概念和基本理论的重要载体.
氮、硫、氯、钠、铝、铁及其化合物是研究基本概念和基本理论的重要载体.| 性质 | 第一电离能 | 熔点 | 半径 | 键能 |
| 对象 | S<Cl | Na<Al | N3->Al3+ | N=N<N≡N |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Al(OH)3
Al(OH)3 AlO2-+H++H2O,加入NaOH溶液,H+被中和,浓度减低,Al(OH)3不断溶解.
AlO2-+H++H2O,加入NaOH溶液,H+被中和,浓度减低,Al(OH)3不断溶解.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | 溶液颜色褪至无色所需时间/s | ||
| 浓度 /mol•L-1 | 体积 /mL | 浓度 /mol•L-1 | 体积 /mL | |||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 | t1 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 | t2 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 | t3 |
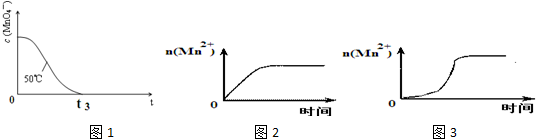
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度 /℃ | 再向试管中加入少量固体 | 溶液颜色褪至无色所需时间/s | ||
| 浓度 /mol•L-1 | 体积 /mL | 浓度 /mol•L-1 | 体积 /mL | ||||
| ④ | 0.10 | 2.0 | 0.010 | 4.0 | 25 | MnSO4 | t4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com