
【题目】某镍冶炼车间排放的漂洗废水中含有一定浓度的Ni2+和Cl-,图甲是双膜三室电沉积法回收废水中Ni2+的示意图,图乙描述的是实验中阴极液pH与镍回收率之间的关系。下列说法不正确的是
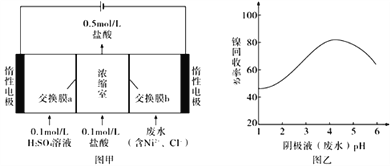
A. 交换膜b为阴离子交换膜
B. 阳极反应式为2H2O-4e-=O2↑+4H+
C. 阴极液pH= 1时,镍的回收率低主要是有较多H2生成
D. 浓缩室得到1L 0.5 mol/L盐酸时,阴极回收得到11.8 g镍
【答案】D
【解析】从电解的示意图可知,最后要得到0.5mol/L的盐酸溶液,因此阴极室内,Ni2++2e-=Ni,溶液中氯离子通过离子交换膜b进入浓缩室内,因此,交换膜b为阴离子交换膜,A正确;电解质为硫酸溶液,阳极内时氢氧根离子失电子生成氧气,极反应式为2H2O-4e-=O2↑+4H+,产生的氢离子通过阳离子交换膜进入浓缩室内,B正确;阴极液pH=1时,溶液中氢离子浓度较大,2H++2e-=H2↑,Ni2+被还原的量减少,因此镍的回收率低,C正确;根据题意可知,浓缩室得到1L 0.5 mol/L盐酸时,新生成的盐酸溶质的量为0.5-0.1=0.4 mol,即阴极有0.4 mol氯离子进入浓缩室,阴极共得电子0.4 mol,若全部为镍离子得电子,根据极反应Ni2++2e-=Ni可知,转移电子0.4 mol 生成11.8 g镍,但是溶液中还会有少量的氢离子得电子,所以生成的镍的质量少于11.8 g,D错误;正确选项D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】石油加工能获得多种化工产品,从物质类别上看主要包含烷烃、烯烃和炔烃等。
(1)石油蒸馏可得分子式为C4H6的烃,其结构可能是1-丁炔,也可能是CH2=CHCH=CH2。下列事实能证明是炔烃而不是CH2=CHCH=CH2的是 __________。
①燃烧时有浓烟 ②能使酸性KMnO4溶液褪色 ③所有原子不在同一平面上 ④与足量溴水反应,生成物中只有2个碳原子上有溴原子
A.①② B.②③ C.③④ D.①④
(2)现有A、B两种烃,它们都来源于石化工业,已知A的分子式为C5Hm, 而B的最简式为C5Hn(m、n均为正整数)。
①下列关于烃A和烃B的说法中不正确的是________(填序号)。
A.烃A和烃B可能互为同系物
B.烃A和烃B可能互为同分异构体
C.当m=12时,烃A一定为烷烃
D.当n=11时,烃B可能的分子式有2种
②若烃A为链状烃,且分子中所有碳原子都在同一条直线上, 则A的结构简式为_____。
③若烃A为链状烯烃,分子中所有碳原子一定共平面,在一定条件下,1 molA最多可与1 molH2加成,则A的名称是____________。
(3)乙炔主要来源之一是石化工业,某研究小组同学为了探究乙炔与HBr发生加成反应后的有关产物,进行以下实验:![]() 。
。
①有机混合物可能含有的物质是_____________(写结构简式)。
②控制反应条件,乙炔经过三步反应可合成![]() ,请写出相应反应方程式___________、________、 ________(可不注明反应条件)。
,请写出相应反应方程式___________、________、 ________(可不注明反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用浓度为0.1000mol/L的盐酸分别逐滴加入到20.00mL0.1000mol/L的两种一元碱MOH、ROH溶液中,pH随盐酸溶液体积的变化如图所示。下列说法正确的是
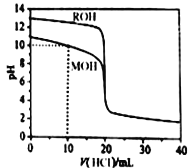
A. pH=10时,溶液中微粒浓度的关系是:c(M+)> c(Cl-)> c(MOH) >c(OH-)>c(H+)
B. 将上述MOH、ROH溶液等体积混合后,用盐酸滴定至MOH恰好反应时,溶液中离子浓度一直保持的关系是:c(R+)>c(M+)>c(OH-)>c(H+)
C. 10mL<V(HCl)<20mL时,溶液中微粒浓度的关系是:c(M+)+c(MOH)<c(Cl-)
D. V(HCl)>20mL时,不可能存在:c(Cl-)>c(M+)=c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
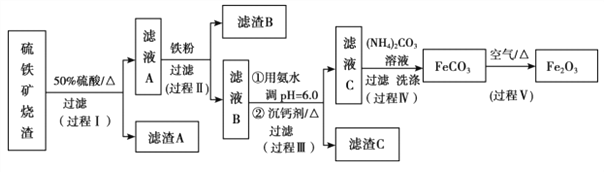
【题目】某课题组以硫铁矿烧渣(含 Fe2O3、 Fe3O4、 Al2O3、 CaO、 SiO2 等)为原料制取软磁用 Fe2O3(要求纯度>99.2%, CaO 含量<0.01%)。其工艺流程如下(所加入试剂均稍过量):
已知:生成氢氧化物的 pH 如下表所示
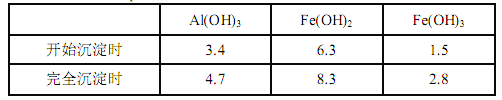
(1)滤渣 A 的主要成分是__________。
(2)在过程Ⅱ中可观察到产生少量气泡,溶液颜色慢慢变浅。能解释该实验现象的离子方程式有__________。
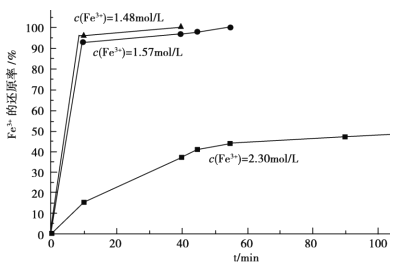
(3)在过程Ⅱ中,课题组对滤液 A 稀释不同倍数后,加入等质量的过量铁粉,得出 Fe3+浓度、还原率和反应时间的关系如图所示:结合上述实验结果说明:课题组选择稀释后c(Fe3+)为 1.60mol/L 左右的理由是______。
(4)在过程Ⅲ中,课题组在相同条件下,先选用了不同沉钙剂进行实验,实验数据见下表:(已知:滤液 B 中钙的含量以 CaO 计为 290—310mg/L)
沉钙剂 | Na2SO3 | H2C2O4 | (NH4)2CO3 | Na2CO3 | NH4F |
用量/g | 2 | 2 | 2 | 5 | 2 |
剩余CaO/mg/L) | 290 | 297 | 290 | 190 | 42 |
根据实验结果, 选择适宜的沉钙剂,得到滤渣 C 的主要成分有__________。
(5)在过程Ⅳ中,反应温度需要控制在 35℃以下,不宜过高,其可能的原因是__________。
(6)在过程Ⅴ中,反应的化学方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,mg下列物质在足量的氧气中充分燃烧后,产物与足量的过氧化钠充分反应,过氧化钠增加了ng,且n>m,符合此要求的物质是( )
①H2 ②HCHO ③CH4 ④HCOOCH3⑤CH3CHO
A. ①② B. ③⑤ C. ①②③④⑤ D. ④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,锥形瓶内装有干燥的气体A,胶头滴管内盛有液体B,若挤压胶头滴管,使液体B滴入瓶中,振荡,一会儿可见小气球C鼓起。则对于气体A和液体B最可能的是 ( )
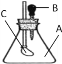
A. A是Cl2,B是饱和食盐水
B. A是CO2,B是NaHCO3饱和溶液
C. A是NO,B是水
D. A是SO2,B是烧碱溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)FeCl3溶液中加入铁粉,溶液由___色变为___色,该反应的离子方程式为______;
(2)除去FeCl3溶液中混有的FeCl2需向溶液中通入______(填物质名称),该反应的离子方程式为______;
(3)在Fe3O4 +4CO![]() 3Fe+4CO 2的反应中,_____是氧化剂,被氧化的元素为____,氧化产物是________,若有11.6g Fe3O4参加反应则转移电子的物质的量为__________。
3Fe+4CO 2的反应中,_____是氧化剂,被氧化的元素为____,氧化产物是________,若有11.6g Fe3O4参加反应则转移电子的物质的量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室模拟工业漂白液(有效成分为NaClO)脱除废水中氨氮(NH3)的流程如下:
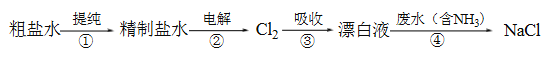
下列分析正确的是
A. ①中采用蒸馏的方法精制粗盐水
B. ②中阳极的主要电极反应:4OH- - 4e- = 2H2O + O2↑
C. ③中制备漂白液的反应:Cl2 + OH- = Cl- + HClO
D. ②、③、④中均发生了氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组学习电化学后。设计了下面的实验装置图(合上电键):
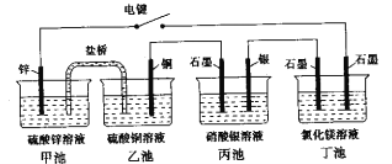
(1)电极名称,铜电极___(填写“正极”、“负极”、“阴极”、“阳极”,下同),银电极_____。
(2)丙池石墨电板上发生的电极反应式为_______,丁池中发生反应的离子方程式为_______。
(3)一段时间,当丙池中生成标准状况下560mL气体时,丁池中理论上最多产生______g固体。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com