
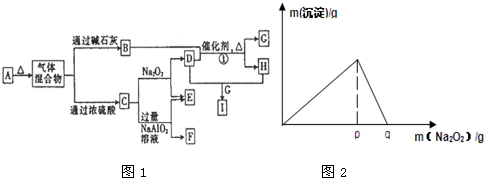
| A、混合物中一定不含有Na2O |
| B、混合物中一定不含有Na2CO3和NaCl |
| C、混合物中肯定含Na2O2、Na2O2和NaHCO3 |
| D、混合物中一定不含有Na2O2和NaCl |


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
| I 溶液的体积(mL) | 4 | 8 | 15 | 20 | 50 | 120 | 150 | |
| C的体积(mL) | 0 | 0 | 112 | 224 | 896 | 2240 | 2240 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 200 | 250 | 300 | 350 |
| 平衡常数K | 9.94 | 5.2 | 1 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 ⑥Al这六种物质中,既能与强酸溶液(如HCl),又能与强碱溶液(如NaOH)反应的有
⑥Al这六种物质中,既能与强酸溶液(如HCl),又能与强碱溶液(如NaOH)反应的有查看答案和解析>>
科目:高中化学 来源: 题型:
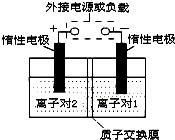 全钒液流储能电池,是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置.现将钒的相关化合物溶解在pH=1的稀硫酸中,按下图组装一个模拟电池.
全钒液流储能电池,是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置.现将钒的相关化合物溶解在pH=1的稀硫酸中,按下图组装一个模拟电池.查看答案和解析>>
科目:高中化学 来源: 题型:
| c(NH4+)?c(OH-) |
| c(NH3?H2O) |
| c(NH3?H2O) |
| c(OH-) |
| c(OH-) |
| c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com