
【题目】25℃时,水的电离达到平衡:H2OH++OH-,下列叙述正确的是 ( )
A.将水加热,![]() 增大,pH不变
增大,pH不变
B.向水中加入少量盐酸,![]() 增大,
增大,![]() 不变
不变
C.向水中加入NaOH固体,平衡逆向移动,![]() 降低
降低
D.向水中加入FeCl3固体,平衡正向移动,![]() 增大
增大
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】阿魏酸在食品、医药等方面有着广泛用途。一种合成阿魏酸的反应可表示为
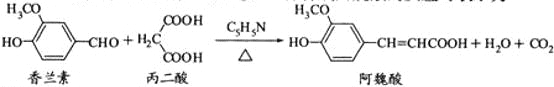
下列说法正确的是
A. 可用酸性![]() 溶液检测上述反应是否有阿魏酸生成
溶液检测上述反应是否有阿魏酸生成
B. 香兰素、阿魏酸均可与![]() 、
、![]() 溶液反应
溶液反应
C. 通常条件下,香兰素、阿魏酸都能发生取代、加成、消去反应
D. 与香兰素互为同分异构体,分子中有4种不同化学环境的氢,且能发生银镜反应的酚类化合物共有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰(CN)2的结构简式为N≡C—C≡N,其化学性质与卤素(X2)很相似,化学上称之为拟卤素,其氧化性介于Br2和I2之间。下列有关反应的化学方程式不正确的是( )
A. (CN)2+H2=2HCN
B. MnO2+4HCN=Mn(CN)2+(CN)2↑+2H2O
C. 向KCN溶液中加入碘水:I2+2KCN=2KI+(CN)2
D. 在NaBr和KCN混合液中通入少量Cl2:Cl2+2KCN=2KCl+(CN)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不能用勒夏特列原理解释的是
A. 红棕色的NO2,加压后颜色先变深后变浅
B. 高压比常压有利于合成SO3的反应
C. 加入催化剂有利于氨的合成
D. 工业制取金属钾Na(l)+KCl(l)![]() NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是( )
A. H2S 的电离方程式:H2S+H2O![]() H3O++HS-
H3O++HS-
B. NaHCO3在水溶液中的电离方程式:NaHCO3= Na++H++CO32-
C. CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D. HS-的水解方程式:HS-+H2O![]() S2-+H3O+
S2-+H3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、制取氨气并完成喷泉实验(图中夹持装置均已略去)。
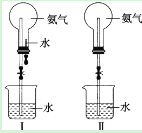
(1)写出实验室制取氨气的化学方程式______。
(2)收集氨气应使用______法,要得到干燥的氨气可选用作干燥剂______。
(3)如果只提供如图Ⅱ所示装置,请说明引发喷泉的方法是______。
Ⅱ.下图是甲、乙两位同学探究铜与稀硝酸反应还原产物的实验装置图,请回答下列问题:
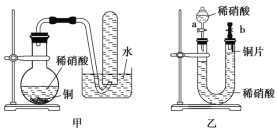
(1)写出铜和稀硝酸反应的离子方程式:______。
(2)实验装置甲能否证明铜和稀硝酸反应的产物是 NO 气体______(填“能”或“不能”),请简述理由(用文字和化学方程式表示):______。
(3)若用实验装置乙进行实验,检查装置气密性的操作是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色”和“生态文明”是未来的发展主题,而CO2的有效利用可以缓解温室效应,解决能源短缺问题。
(1)CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) △H
2CO(g)+2H2(g) △H
已知:反应1 CH4(g)═C(s)+2H2(g) △H1= +75kJ/mol
反应2 2CO(g)═C(s)+CO2(g) △H2=-172kJ/mol
则该催化重整反应的△H=___kJmol-1。
(2)有科学家提出可利用FeO吸收CO2:6FeO(s)+CO2(g)![]() 2Fe3O4(s)+C(s),对该反应的描述正确的是__。
2Fe3O4(s)+C(s),对该反应的描述正确的是__。
A.增大FeO的投入量,利于平衡正向移动
B.压缩容器体积,可增大CO2的转化率,c(CO2)减小
C.恒温恒容下,气体的密度不变可作为平衡的标志
D.恒温恒压下,气体摩尔质量不变可作为平衡的标志
E.若该反应的△H﹤0,则达到化学平衡后升高温度,CO2的物质的量会增加
(3)为研究CO2与CO之间的转化,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)![]() 2CO(g) H,测得压强、温度对CO的体积分数[φ(CO)%]的影响如图所示,回答下列问题:
2CO(g) H,测得压强、温度对CO的体积分数[φ(CO)%]的影响如图所示,回答下列问题:
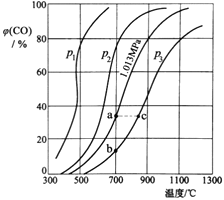
①图中p1、p2、p3的大小关系是______,图中a、b、c三点对应的平衡常数Ka、Kb、Kc的大小关系是______。
②900℃、1.013MPa时,1molCO2与足量碳反应达平衡后容器的体积为VL,CO2的转化率为___(保留一位小数),该反应的平衡常数K=___。
③将②中平衡体系温度降至640℃,压强降至0.1013MPa,重新达到平衡后CO2的体积分数为50%。条件改变时,正反应速率______逆反应速率(填“>”、“<”或“=”)。
(4)在NaOH溶液中通入一定量的CO2气体,所得溶液中c(HCO3-):c(CO32-)=4:1,此时溶液pH=______。(已知:室温下,H2CO3的k1=4×10-7,k2=5×10-11。lg2=0.3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中的一定量混合气体发生反应:xA(g) + yB(g)![]() zC(g),达到平衡后,测得A的浓度为0.5mol/L,保持温度不变,将容器体积变为原来的两倍,当达到新的平衡时,测得A的浓度为0.23mol/L,则下列叙述错误的是 ( )
zC(g),达到平衡后,测得A的浓度为0.5mol/L,保持温度不变,将容器体积变为原来的两倍,当达到新的平衡时,测得A的浓度为0.23mol/L,则下列叙述错误的是 ( )
A.平衡向正反应方向移动了B.物质C的质量分数增大了
C.物质A的转化率减小了D.x+y<z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100mL无色溶液可能含有Na+、NH4+、Mg2+、Al3+、Fe3+、CO32-、Cl-中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)
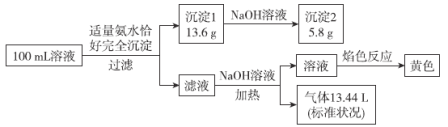
下列说法错误的是( )
A.原溶液一定存在Na+、NH4+、Mg2+、Al3+和Cl-,一定不存在Fe3+、CO32-
B.原溶液中c(NH4+)=1mol·L-1
C.沉淀2的成分为Mg(OH)2
D.原溶液中c(Cl-)≥6mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com