
| A. | 误食重金属盐引起人体中毒,可喝大量的食盐水解毒 | |
| B. | 光纤通信使用的光缆主要成分是Si,太阳能电池使用的材料主要是SiO2 | |
| C. | 陶瓷、砖瓦、玻璃、水泥等,都是硅酸盐产品 | |
| D. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 |
分析 A.食盐水不能解重金属盐中毒;
B.二氧化硅具有对光良好的全反射作用,Si为常见的半导体材料;
C.陶瓷、砖瓦、玻璃、水泥的主要成分均为硅酸盐;
D.铜制品不能发生析氢腐蚀.
解答 解:A.食盐水不能解重金属盐中毒,则误食重金属盐引起人体中毒,可喝大量的牛奶、豆浆等解毒,故A错误;
B.二氧化硅具有对光良好的全反射作用,Si为常见的半导体材料,则光纤通信使用的光缆主要成分是SiO2,太阳能电池使用的材料主要是Si,故B错误;
C.陶瓷、砖瓦、玻璃、水泥的主要成分均为硅酸盐,则都是硅酸盐产品,故C正确;
D.铜制品不能发生析氢腐蚀,则钢铁制品既能发生吸氧腐蚀又能发生析氢腐蚀,故D错误;
故选C.
点评 本题考查物质的组成、结构与性质,为高频考点,把握物质的性质、应用及化学与生活的关系为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.


科目:高中化学 来源: 题型:解答题
| M(OH)n | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 2.0×10-32 | 4.1 | - |
| Fe(OH)3 | 3.5×10-38 | 2.2 | 3.5 |
| Fe(OH)2 | 1.0×10-15 | 7.5 | 9.5 |
| Ni(OH)2 | 6.5×10-18 | 6.4 | 8.4 |
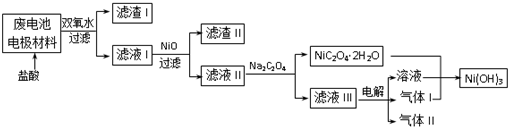
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制盐酸溶液用量筒量取盐酸时,俯视刻度线 | |
| B. | NaOH溶解后未经冷却就注入容量瓶并定容至刻度线 | |
| C. | 称量11.7 g NaCl配制0.2 mol•L-1NaCl溶液1 000 mL时,砝码错放在左盘 | |
| D. | 配制盐酸溶液定容时,仰视容量瓶刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20 g D2O所含的电子数为10 NA | |
| B. | 6.0gSiO2晶体中含有0.2NA个Si-O键 | |
| C. | 氢气与氯气反应生成标准状况下22.4 L氯化氢,断裂化学键总数为2 NA | |
| D. | 苯与液溴反应生成1mol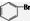 时消耗0.5NA个Br2 时消耗0.5NA个Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
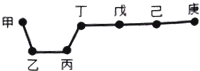 短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素.下列判断正确的是( )
短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素.下列判断正确的是( )| A. | 甲与己形成的化合物一定是离子化合物 | |
| B. | 简单气态氢化物的稳定性:庚>己>戊 | |
| C. | 乙、丙、丁的最高价氧化物水化物可以相互反应 | |
| D. | 庚的最高价氧化物水化物酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:Fe2++2H++H2O2═Fe3++2H2O | |
| B. | 已知同温度下的溶解度:Zn(OH)2>ZnS,Na2S溶液与ZnCl2溶液混合:Zn2++S2-+2H2O═Zn(OH)2↓+H2S↑ | |
| C. | 0.01 mol•L-1NH4Al(SO4)2溶液与0.02 mol•L-1 Ba(OH)2溶液等体积混合:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| D. | 向KI-淀粉溶液中加入稀硫酸,在空气中放置一段时间后,溶液呈蓝色:4H++4I-+O2═2I2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | a | b | 实验现象预期 | 结论 | 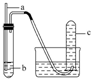 |
| A | 铜丝 | 稀硝酸 | 试管c中有大量红棕色气体 | 硝酸有强氧化性 | |
| B | 木条 | 18.4mol•L-1 硫酸 | 木条变黑 | 浓硫酸有酸性及氧化性 | |
| C | 生铁 | 醋酸溶液 | c中有大量无色气体 | 生铁发生析氢腐蚀 | |
| D | 铁丝 | 含少量HCl的H2O2溶液 | 试管c中有大量无色气体 | 该反应中铁作催化剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
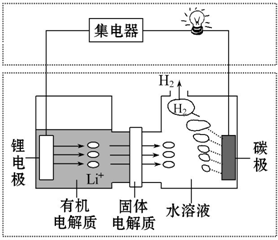
| A. | 碳极发生的反应:2H2O+2e-═H2↑+2OH- | |
| B. | 有机电解质和水溶液不可以互换区域 | |
| C. | 理论上外电路中每转移1 mol电子,负极消耗的质量为7 g | |
| D. | 若该电池可以充电,充电时碳极接外加电源的负极,锂极接外加电源的正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1的氯化铁溶液中,若Fe3+的数目为 NA,则Cl-的数目为3NA | |
| B. | 常温下,1 mol Fe与足量稀HNO3反应,转移电子的数目为2 NA | |
| C. | 8.0gCu2S和CuO的混合物中含有的铜原子数为0.1NA | |
| D. | 标准状况下,2.24 LCl2溶于水,转移电子的数目为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com