
铝土矿(主要成分为Al2O3,还有少量杂质)是提取氧化铝的原料。提取氧化铝的工艺流程如下:

(1)请用离子方程式表示以上工艺流程中第①步反应:___________________ 。
(2)写出以上工艺流程中第③步反应的化学方程式:_______________________。
(3)金属铝与氧化铁混合点燃,会发生剧烈的反应。该反应的化学方程式为 __
________________________________________________________________。
请举一例该反应的用途______________________________________________。
(4)电解熔融氧化铝制取金属铝,若有0.6 mol电子发生转移,理论上能得到金属铝的质量是 ____________。
(1)工艺流程中第①步反应实质是NaOH溶液与Al2O3的反应,离子方程式为Al2O3+2OH-====2Al +H2O。
+H2O。
(2)工艺流程中第③步反应的化学方程式为NaAlO2+CO2+2H2O====Al(OH)3↓+NaHCO3或2NaAlO2+CO2+3H2O====2Al(OH)3↓+Na2CO3。
(3)金属铝与氧化铁混合后点燃,会发生剧烈的反应。该反应的化学方程式为2Al+Fe2O3 2Fe+Al2O3,利用该反应可以焊接钢轨。
2Fe+Al2O3,利用该反应可以焊接钢轨。
(4)电解熔融氧化铝制取金属铝的化学方程式为2Al2O3 4Al+3O2↑,由方程式可知,若有0.6 mol电子发生转移,理论上能得到金属铝的物质的量为0.2 mol,质量为5.4 g。
4Al+3O2↑,由方程式可知,若有0.6 mol电子发生转移,理论上能得到金属铝的物质的量为0.2 mol,质量为5.4 g。
答案:(1)Al2O3+2OH-====2Al +H2O
+H2O
(2)NaAlO2+CO2+2H2O====Al(OH)3↓+NaHCO3或2NaAlO2+CO2+3H2O====2Al(OH)3↓+Na2CO3
(3)2Al+Fe2O3 2Fe+Al2O3 焊接钢轨
2Fe+Al2O3 焊接钢轨
(4)5.4 g


科目:高中化学 来源: 题型:
钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用。
完成下列计算:
(1)叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊。若产生40.32 L(标准状况下)氮气,至少需要叠氮化钠________g。
(2)钠钾合金可在核反应堆中用作热交换液。5.05 g钠钾合金溶于200 mL水生成0.075 mol氢气。
①计算溶液中氢氧根离子的物质的量浓度(忽略溶液体积变化)。
②计算并确定该钠钾合金的化学式。
(3)氢氧化钠溶液处理铝土矿并过滤,得到含铝酸钠的溶液。向该溶液中通入二氧化碳,有下列反应:
2NaAl(OH)4+CO2—→2Al(OH)3↓+Na2CO3+H2O
已知通入二氧化碳336 L(标准状况下),生成24 mol Al(OH)3和15 mol Na2CO3,若通入溶液的二氧化碳为1 12 L(标准状况下),计算生成的Al(OH)3和Na2CO3的物质的量之比。
12 L(标准状况下),计算生成的Al(OH)3和Na2CO3的物质的量之比。
(4)常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失。
| 氢氧化钠质量(g) | 氯化钠质量(g) | |
| ① | 2.40 | 3.51 |
| ② | 2.32 | 2.34 |
| ③ | 3.48 | 3.51 |
上述实验①②③所用氢氧化钠均不含杂质,且实验数据可靠。通过计算,分析和比较上表3组数据,给出结论。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于Na2CO3和NaHCO3性质的说法错误的是 ( )
A.热稳定性:NaHCO3<Na2CO3
B.与同浓度盐酸反应的剧烈程度:NaHCO3<Na2CO3
C.相同温度时,在水中的溶解性:NaHCO3<Na2CO3
D.等物质的量浓度溶液的pH:NaHCO3<Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定质量的Al、Fe混合物加入到足量的盐酸中,充分反应后得到标准状况下的氢气8.96 L;如果将等质量的该混合物加入到足量的NaOH溶液中,充分反应后得到标准状况下的氢气6.72 L。
(1)写出涉及反应的化学方程式: _ _ _ _ _ _ _ _ _ _ _ _ _ ___ _ _ _。
(2)混合物中Al和Fe的质量分别为__ ___ _ _ 和____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在四种化合物①NaHCO3、②Al(OH)3、③Al2O3、④NaAlO2中,与盐酸和氢氧化钠溶液都能反应的是( )
A.只有②④ B.只有①②
C.只有①②③ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列有FeCl3溶液参加的反应中,与Fe3+发生氧化还原反应的是( )
①FeCl3与Cu反应 ②FeCl3与H2S反应 ③FeCl3与KI反应 ④FeCl3滴入沸水中 ⑤FeCl3与NaHCO3反应 ⑥FeCl3溶液中滴入石蕊试液
A.③④⑤⑥ B.③④⑤ C.④⑤⑥ D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度与加入铁粉的物质的量之间的关系如图所示。则溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )
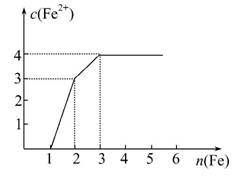
A.1∶1∶1 B.1∶3∶1
C.3∶3∶8 D.1∶1∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
下面是四个化学反应,你认为理论上不能用于设计原电池的化学反应是( )
A.2Al+2NaOH+2H2O===2NaAlO2+3H2↑
B.2H2+O2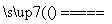 2H2O
2H2O
C.Mg3N2+6H2O===3Mg(OH)2↓+2NH3↑
D.CH4+2O2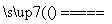 CO2+2H2O
CO2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
一个原电池的总反应方程式为Zn+Cu2+===Zn2++Cu,该原电池可能为( )
| A | B | C | D | |
| 正极 | Cu | Al | Zn | Fe |
| 负极 | Zn | Zn | Cu | Zn |
| 电解质溶液 | H2SO4 | CuSO4 | ZnCl2 | CuCl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com