
设NA为阿伏伽德罗常数的值。下列说法不正确的是( )
A.28 g由C2H4和C3H6组成的混合物中含有氢原子的数目为4 NA
B.1 L 0.1 mol·L-1的NH4Cl溶液中含有Cl-数目为0.1NA
C.1 mol Na2O2固体与足量CO2反应转移电子数为1NA
D.标准状况下,2.24 L的 二氯甲烷中含有的碳氯共价键的数目为0.2NA
二氯甲烷中含有的碳氯共价键的数目为0.2NA
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源:2016-2017学年辽宁省高二上期中化学卷(解析版) 题型:选择题
已知:H2(g)+Br2(g)=2HBr(g) ;△H=-72kJ/mol.蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
化学物质 | H2(g) | Br2(g) | HBr(g) |
1mol分子中的化学键断裂时 需要吸收的能量/KJ | 436 | a | 369 |
则上述表格中的a值为
A.404 B.344 C.260 D.200
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省铁岭市协作体高三第三次联考化学试卷(解析版) 题型:选择题
在1200℃时,天然气脱硫工艺中会发生下列反应:
①H2S(g)+ O2(g)═SO2(g)+H2O(g) △H1
O2(g)═SO2(g)+H2O(g) △H1
②2H2S(g)+SO2(g)═ S2(g)+2H2O(g) △H2
S2(g)+2H2O(g) △H2
③H2S(g)+ O2(g)═S(g)+H2O(g )△H3
O2(g)═S(g)+H2O(g )△H3
2S(g)═S2(g)△H4 则△H4的正确表达式为( )
A. △H4=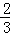 (△H1+△H2﹣3△H3) B. △H4=
(△H1+△H2﹣3△H3) B. △H4=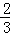 (3△H3﹣△H1﹣△H2)
(3△H3﹣△H1﹣△H2)
C. △H4= (△H1+△H2﹣3△H3) D. △H4=
(△H1+△H2﹣3△H3) D. △H4= (△H1﹣△H2﹣3△H3)
(△H1﹣△H2﹣3△H3)
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省高三第三次月考化学试卷(解析版) 题型:选择题
在体积均为1.0 L的恒容两个密闭容器中分别 加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应CO2(g)+C(s) 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是( )
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是( )

A.化学平衡常数K:K(状态I) < K(状态II) <K(状态III)
B.CO2的平衡转化率α:α(状态I) <α(状态Ⅱ)=α(状态III)
C.体系中c(CO):c (CO,状态Ⅱ) < 2c (CO,状态Ⅲ)
D.逆反应速率v逆:v逆(状态Ⅰ)> v逆(状态Ⅲ)
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省高三第三次月考化学试卷(解析版) 题型:选择题
下列事实或实验可以表明H2SO3的酸性强于H2CO3的是( )
A.硫的非金属性比碳强
B.SO2气体依次通过NaHCO3溶液、澄清石灰水,澄清石灰水变浑浊
C.SO2和CO2气体分别通入水中至饱和,测定两溶液的pH,前者小于后者
D.室温下测定均为0.1mol/L的NaHSO3和NaHCO3溶液的pH,前者小于后者
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省高三第三次月考化学试卷(解析版) 题型:选择题
化学与生产、生活密切相关。下列叙述中正确的是( )
A.用活性炭为糖浆脱色和用臭氧漂白纸浆,原理相似
B.石油裂化的主要目的是为了提高轻质液体燃料的产量
C.2014年在西非国家爆发了埃博拉疫情,埃博拉病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的
D.煎炸食物的花生油和牛油都是可皂化的饱和酯类
查看答案和解析>>
科目:高中化学 来源:2017届江西省、兴国三中等四校高三上第一次联考化学卷(解析版) 题型:选择题
把500mLNH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入含amol氢氧化钠的溶液加热,恰好使NH 完全转化为NH3逸出,另取一份加入含bmolHCl的盐酸恰好反应完全,则该混合溶液中c(Na+)为
完全转化为NH3逸出,另取一份加入含bmolHCl的盐酸恰好反应完全,则该混合溶液中c(Na+)为
A.(2b-a) mol/L B.(10b-5a) mol/L
C. mol/L D.
mol/L D. mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上期中化学试卷(解析版) 题型:实验题
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示(夹持仪器已略去)。

A B
(1)实验前,应先检查装置的 ;实验中产生的尾气应通入 溶液。
(2)实验过程中需要配制100mL1mol/L FeCl3溶液(未用浓盐酸酸化),所需要的玻璃仪器有:烧杯、量筒、胶头滴管、玻璃棒、 。
(3)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色,然后开始实验。
步骤① | 配制1 mol·L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装 |
写出装置A中产生SO2的化学方程式: 。
(4)当SO2通 入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象。将混合液放置12小时,溶液才变成浅绿色。
入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象。将混合液放置12小时,溶液才变成浅绿色。
【查阅资料】 Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+。生成Fe(HSO3)2+离子的反应为可逆反应。
解释SO2与FeCl3溶液反应生成红棕色Fe(HSO3)2+离子的原因(用化学用语解释): 。
写出溶液中Fe(HSO3)2+离子与Fe3+反应的离子方程式:  。
。
(5)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学 进行了步骤③的实验。
进行了步骤③的实验。
步骤② | 往5mL1mol·L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色。微热3 min,溶 |
步骤③ | 往5mL重新配制的1mol·L-1 FeCl3溶液(用浓盐酸酸化)中通入SO |
⑹综合上述实验探究过程,可以获得的实验结论:
I.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
II.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
III. 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年青海师大附中高一上期中化学试卷(解析版) 题型:推断题
某无色溶液中可能含有:Na+、Ba2+、Cu2+、CO32-、Cl-、Mg2+。
①向此溶液中滴加稀HCl无明显现象
②取少许①的溶液并加入少量的Na2SO4溶液,有白色沉淀产生
③取②的上层清液并加入过量的NaOH溶液,无明显的现象
请回答下列问题:
(1)原溶液中一定含有的离子是_________,一定不含的离子是_________,不能确定是否含有的离子是__________。
(2)②中的离子方程式是____________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com