
【题目】在电解冶炼铝的过程中加入冰晶石(Na3AlF6)可起到降低Al2O3熔点的作用。
(1)基态氟原子中,电子占据的最高能层的符号为______,电子占据最高能级上的电子数为______。
(2)向NaAlO2及氟化钠溶液中通入CO2,可制得冰晶石。
①该反应中涉及的非金属元素的电负性由大到小的顺序为______________。
②1molCO2中含有的σ键数目为________,其中C原子的杂化方式为_________;CO2与SCNˉ互为等电子体,SCNˉ的电子式为_________。
③Na2O的熔点比NaF的高,其理由是:_________。
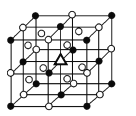
(3)冰晶石由两种微粒构成,冰晶石的晶胞结构如图所示,●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处△所代表的微粒是________(填微粒符号)。
(4)冰晶石稀溶液中存在的化学键有________(填标号)。
A 离子键 B 共价键 C 配位键 D 氢键
(5)金属铝晶体中的原子堆积方式为面心立方最密堆积,其晶胞参数为apm,则铝原子的半径为______pm。
【答案】L 5 F>O>C 2NA sp ![]() 二者都是离子晶体,O2-所带电荷比F-多,氧化纳的晶格能大于氟化钠 Na+ BC
二者都是离子晶体,O2-所带电荷比F-多,氧化纳的晶格能大于氟化钠 Na+ BC ![]()
【解析】
氟原子是9号元素,根据核外电子排布规律进行解答;电负性变化规律为从左到右依次增大,从下到上依次增大;CO2的结构式为O=C=O;离子晶体,离子所带电荷越多、半径越小晶格能越大,熔沸点越高;冰晶石的化学式为Na3AlF6,由Na+和AlF6-两种微粒个数比为3:1,利用均摊法计算出粒子数,与冰晶石的微粒数比相同,据此解答;面心立方堆积,根据原子半径和边长之间的几何关系进行分析。
(1)氟原子是9号元素,位于第二周期第ⅦA族,其电子占据的最高能层的符号为L,根据构造原理,氟原子的核外电子排布式为1s22s22p5,电子占据最高能级为2p,其轨道上的电子数为5,答案为:L;5;
(2)①该反应中涉及的非金属元素为C、O、F,同周期电负性从左到右依次增大,所以电负性由大到小的顺序为F>O>C,故答案为:F>O>C;
②CO2的结构式为O=C=O,则1molCO2中含有的σ键数目为2NA个,C原子的杂化方式为sp杂化,SCNˉ与CO2互为等电子体,电子式相似,则SCNˉ的电子式为![]() ,答案为:2NA;sp;
,答案为:2NA;sp;![]() ;
;
③Na2O和NaF都是离子晶体,O2-所带电荷比F-多,则氧化纳的晶格能大于氟化钠,答案为:二者都是离子晶体,O2-所带电荷比F-多,氧化纳的晶格能大于氟化钠;
(3)利用均摊法计算,●位于大立方体的顶点和面心,则●的数目为![]() ,○位于大立方体的12条棱的中点和8个小立方体的体心,则○的数目为
,○位于大立方体的12条棱的中点和8个小立方体的体心,则○的数目为![]() ,冰晶石由Na+和AlF6-两种微粒3:1组成,那么大立方体的体心处△所代表的微粒是Na+,答案为:Na+;
,冰晶石由Na+和AlF6-两种微粒3:1组成,那么大立方体的体心处△所代表的微粒是Na+,答案为:Na+;
(4)冰晶石稀溶液,已经完全电离,不存在离子键,其中存在的化学键有共价键和配位键,答案为:BC;
(5)金属铝晶体中的原子堆积方式为面心立方最密堆积,其原子半径r和边长a的关系为![]() ,已知晶胞参数为apm,则铝原子的半径为
,已知晶胞参数为apm,则铝原子的半径为![]() ,答案为:
,答案为:![]() 。
。


 全能测控期末小状元系列答案
全能测控期末小状元系列答案 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:
【题目】铜及其化合物在生产、生活中有广泛应用。回答下列问题:
(1)铜和锌相邻,铜和锌的几种状态:①铜:[Ar]3d10;②铜:[Ar]3d104s1③铜:[Ar]3d104p1④锌:[Ar]3d104s1⑤锌:[Ar]3d104s2。它们都失去1个电子时需要的能量由大到小排序为 ___(填字母)。
a.①⑤④②③ b.①④⑤②③ c.②①③⑤④ d.⑤①④③②
画出基态铜原子的价电子排布图____。
(2)Cu2+与NH3·H2O等形成配离子。[Cu(NH3)4]2+中2个NH3被2个H2O取代得到两种结构的配离子,则[Cu(NH3)4]2+的空间构型是____(填“正四面体”或“正四边形”)。
(3)CuF2晶体的熔点为836℃。其能量循环图示如下(a、b、c 等均大于0):

F-F键能为 ___kJmol-1,CuF2(s)的晶格能为 ___kJmol-1。
(4)铜常作醇氧化反应的催化剂。M中C原子的杂化类型有 ___种,M的熔沸点比N的高,原因是 ___。
![]()
![]()
![]()
(5)磷青铜晶胞结构如图所示。NA代表阿伏加德罗常数的值,铜、磷原子最近距离为![]()
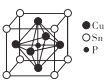
①铜与铜原子最近距离为____nm。
②磷青铜晶体密度为___ gcm-3(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,对于可逆反应A(g)+3B(g) ![]() 4C(g)的叙述中,能说明反应已达到平衡的是( )
4C(g)的叙述中,能说明反应已达到平衡的是( )
A.单位时间内消耗4a mol的C同时分解a mol AB.混合气体的物质的量不再变化
C.单位时间内消耗3a mol B同时生成4a mol CD.容器内的压强不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种“氢氧化锶-氯化镁法”制备“牙膏用氯化锶(SrCl2·6H2O)”的工艺流程如下:
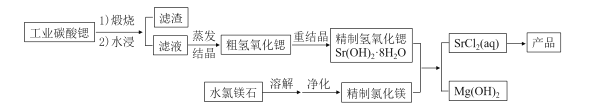
(1)锶与钙元素同主族。金属锶应保存在_______中(填“水”、“乙醇”或“煤油”)。
(2)天青石(主要成分SrSO4)经过多步反应后可制得工业碳酸锶。其中第一步是与过量焦炭隔绝空气微波加热还原为硫化锶,该过程的化学方程式为__________。
(3)工业碳酸锶中含有CaCO3、MgCO3、BaCO3等杂质。“滤渣”的主要成分是______。
(4)“重结晶”时蒸馏水用量(以质量比mH2O:mSrO表示)对Sr(OH)2·8H2O纯度及产率的影响如下表。最合适的质量比为____________,当质量比大于该比值时,Sr(OH)2·8H2O产率减小,其原因是_____。
质量mH2O:mSrO | 4:1 | 5:1 | 6:1 | 7:1 | 8:1 | 9:1 | 10:1 |
Sr(OH)2·8H2O纯度% | 98.64 | 98.68 | 98.65 | 98.64 | 98.63 | 98.63 | 98.65 |
Sr(OH)2·8H2O产率% | 17.91 | 53.36 | 63.50 | 72.66 | 92.17 | 89.65 | 88.93 |
(5)水氯镁石是盐湖提钾后的副产品,其中SO42-含量约为1%,“净化”过程中常使用SrCl2 除杂,写出该过程的离子方程式__________。
(6)将精制氢氧化锶完全溶于水,与氯化镁溶液在90℃时反应一段时间,下列判断MgCl2是否反应完全的最简易可行的方法是______(填标号)。
A 反应器中沉淀量不再增加 B 测定不同时间反应液pH
C 测定Sr2+浓度变化 D 向反应器中滴加AgNO3溶液观察是否有沉淀
(7)若需进一步获得无水氯化锶,必须对SrCl2·6H2O(M=267g·mol-1)进行脱水。脱水过程采用烘干法在170℃下预脱水,失重达33.7%,此时获得的产物化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在进行锌铜双液原电池实验时,若用铜丝代替盐桥(如图),外电路中仍然存在较小的电流,随着时间 的推移,电流逐渐减小。下列关于该装置说法错误的是
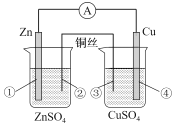
A.左池形成了原电池,Zn极的电势最高
B.铜丝②附近溶液的pH将升高
C.右池为电解池,铜丝③的反应式为 Cu-2eˉ=Cu2+
D.铜片④上有新的亮红色固体附着
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】脱氢醋酸钠是FAO和WHO认可的一种安全型食品防霉、防腐保鲜剂,它是脱氢醋酸的钠盐。脱氢醋酸的一种制备方法如图:
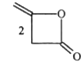 (a双乙烯酮)
(a双乙烯酮)![]()
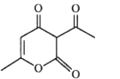 (b脱氢醋酸)
(b脱氢醋酸)
下列说法错误的是
A.a分子中所有原子处于同一平面B.a.b均能使酸性KMnO4溶液褪色
C.a、b均能与NaOH溶液发生反应D.b与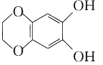 互为同分异构体
互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)常温下为无色液体,是应用广泛的化工原料和前景乐观的燃料。
(1)已知:CH4(g)+H2O(g)CO(g)+3H2(g) H=+206.0kJ/mol-1
CH4(g)+H2O(g)CH3OH(g)+H2(g) H=+77.0kJ/mol-1
则CO和H2反应生成CH3OH(g)的热化学方程式是______________________。
(2)甲醇可用于合成3,5-二甲氧基苯酚,反应如下:
 +2CH3OH
+2CH3OH![]()
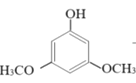 +2H2O
+2H2O
反应结束后,先分离出甲醇,再加入乙醚,将获得的有机层(含少量氯化氢)进行洗涤,然后分离提纯得到产物。甲醇和3,5-二甲氧基苯酚的部分物理性质见表:
物质 | 沸点/℃ | 熔点/℃ | 溶解性 |
甲醇 | 64.7 | -97.8 | 易溶于水 |
3,5-二甲氧基苯酚 | 172~175 | 33~36 | 易溶于甲醇、乙醚,微溶于水 |
①分离出甲醇的操作是______________________(填字母序号)。
a.蒸馏 b.分液 c.结晶
②洗涤时,可用于除去有机层中的氯化氢的试剂是______________________(填字母序号)。
a.Na2CO3溶液 b.NaHCO3溶液 c.NaOH溶液
(3)甲醇可用于实验室制备丙炔酸甲酯(CH![]() C—COOCH3,沸点为103~105℃)。
C—COOCH3,沸点为103~105℃)。
反应为:CH≡C—COOH+CH3OH![]() CH≡C—COOCH3+H2O
CH≡C—COOCH3+H2O
实验步骤如下:
步骤1:在反应瓶中,加入14g丙炔酸、50mL甲醇和2 mL浓硫酸,搅拌,加热回流一段时间。
步骤2:蒸出过量的甲醇(装置如图所示)。

步骤3:反应液冷却后,依次用饱和NaCl溶液、5%Na2CO3溶液、水洗涤。分离出有机相。
步骤4:有机相经无水Na2SO4干燥、过滤、蒸馏,得丙炔酸甲酯。
①仪器A的名称是______________,蒸馏烧瓶中加入碎瓷片的目的是_______________。
②步骤3中,用5%Na2CO3溶液洗涤,主要除去的物质是______________________;分离出有机相的操作名称为_____________________。
③步骤4中,蒸馏时不能用水浴加热的原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)热值高、无污染,既可做燃料,又是重要的化工原料。科学家正研究利用CO2生产甲醇以发展低碳经济。
(1)已知CO(g)和CH3OH(l)的燃烧热分别为283kJmol-1和726kJmol-1。则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为______。
(2)根据甲醇在酸性电解质溶液中与氧气作用生成二氧化碳和水的反应,设计一种燃料电池,则其负极反应式为______。若该燃料电池消耗1mol甲醇所能产生的最大电能为689.7kJ,与其燃烧所能释放的全部能量相比,该燃料电池的理论效率为______。
(3)探究不同条件下对合成甲醇反应的影响:CO2(g)+3H2(g)CH3OH(g)+H2O(g)。
①其他条件不变,T1、T2两种温度下CH3OH的物质的量随时间的变化如图,则该反应在T1时的平衡常数比T2时的______(填“大”、“小”),处于A点的反应体系从T1变到T2,达到平衡时 ______(填“增大”、“减小”或“不变”)。
______(填“增大”、“减小”或“不变”)。
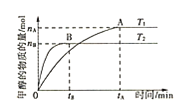
②某温度下,在体积为1L的密闭容器中加入4molCO2、8molH2,测得H2的物质的量随时间变化如图曲线(甲)所示:

则a→b时间段内v(CH3OH)=______molL-1min-1;若仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线(乙)所示。曲线(乙)对应改变的实验条件可以是______(填序号)。
A.加催化剂 B.增大压强 C.升高温度 D.增大CO2浓度
若图中曲线甲平衡后保持恒温恒容,按如表各组的物质的量再次增加投入反应混合物,其中平衡向正反应方向进行的是______。
物质 | n(CO2) | n(H2) | n(CH3OH) | n(H2O) |
A | 0 | 0 | 1 | 1 |
B | 1 | 0 | 1 | 0 |
C | 0 | 1 | 1 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法错误的是( )
A.128 g HI加热充分分解生成氢气的分子数为0.5NA
B.15 g乙酸与甲酸甲酯的混合物中含氧原子总数为0.5NA
C.标准状况下,1.12 L氖气与1.12 L甲烷所含质子总数均为0.5NA
D.0.2mol![]() 与0.5mol
与0.5mol![]() 在光照下充分反应,产物中C—Cl键总数为0.5NA
在光照下充分反应,产物中C—Cl键总数为0.5NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com