
| A、标准状况下,22.4 L水含有的水分子数为NA |
| B、常温常压下,22 g CO2含有的CO2分子数为0.5NA |
| C、标准状况下,1 mol CH4分子的电子数为8 NA |
| D、物质的量浓度为1mol/L的AlCl3溶液中,Cl- 的物质的量浓度为1mol/L |
| m |
| M |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、22.4 L CO2与CO的混合气体中含碳原子数为NA |
| B、常温下,1L 0.1 mol?L-1的NH4NO3溶液中氮原子数为0.2 NA |
| C、在反应KIO3+6HI=KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6 NA |
| D、在铁参与的反应中,5.6 g铁完全反应失去的电子数一定为0.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、碳酸氢钠溶液呈碱性:HCO
| ||||
| B、FeS固体放入稀硝酸中:FeS+2H+=Fe2++H2S↑ | ||||
C、用饱和碳酸钠溶液多次浸取BaSO4固体:BaSO4+CO
| ||||
D、向KHCO3溶液中滴入少量的Ba(OH)2溶液:HC
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、112L/h |
| B、224 L/h |
| C、448 L/h |
| D、560L/h |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阴离子 | OH-、Cl-、C
| ||||||
| 阳离子 | H+、Na+、Al3+、Ag、Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
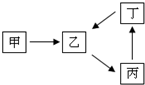 甲、乙、丙、丁四种物质转化关系如右图.已知甲是地壳中含量最高的元素组成的单质,化合物乙、丙、丁均含有第三周期一种相同元素.
甲、乙、丙、丁四种物质转化关系如右图.已知甲是地壳中含量最高的元素组成的单质,化合物乙、丙、丁均含有第三周期一种相同元素.| 温度/℃ | 400 | 450 | 500 | 550 | 600 | 650 |
| 转化率/% | 99.2 | 97.5 | 93.5 | 85.6 | 73.7 | 58.5 |
| 3 |
| 4 |
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com