
【题目】将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
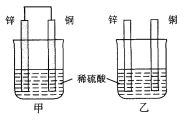
A. 两烧杯中铜片表面均无气泡产生
B. 甲、乙两装置均将化学能转变为电能
C. 两烧杯中溶液均变蓝色
D. 一段时间后,两烧杯中溶液的c(H+)均减小
【答案】D
【解析】
甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,总反应式为:Zn+H2SO4=ZnSO4+H2↑;乙装置中只是锌片与稀硫酸间发生了置换反应:Zn+H2SO4=ZnSO4+H2↑,以此进行分析。
A.甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,所以甲中铜片表面有气泡产生,故A错误;
B.甲中形成铜锌原电池,将化学能转变为电能,乙装置中只是锌片与稀硫酸间发生了置换反应,故B错误;
C.甲、乙两烧杯中,铜片均未参与反应,所以溶液均不变蓝色,故C错误;
D.甲中铜片上氢离子得电子生成氢气,乙中锌和稀硫酸发生置换反应生成氢气,所以两烧杯的溶液中氢离子浓度均减小,故D正确。
故选D。


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】关于合理饮食有利于健康的下列说法不正确的是( )
A.没有水就没有生命B.养成良好的饮食习惯,多吃蔬菜、水果等碱性食物
C.饮用水越纯净越好D.调味剂和营养剂不是加得越多越好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学常用的酸碱指示剂酚酞的结构简式如图所示,下列关于酚酞的说法正确的是( )
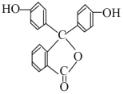
A. 酚酞分子中的所有碳原子在同一平面上 B. 酚酞的分子式为C20H14O4
C. 1mol酞最多与2molNaOH发生反应 D. 酚酞分子与苯酞互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从溴乙烷制取1, 2-二溴乙烷,下列转化方案中最好的是
A. CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH2=CH2
CH2=CH2![]() CH2BrCH2Br
CH2BrCH2Br
B. CH3CH2Br![]() CH2BrCH2Br
CH2BrCH2Br
C. CH3CH2Br![]() CH2=CH2
CH2=CH2![]() CH2BrCH3
CH2BrCH3![]() CH2BrCH2Br
CH2BrCH2Br
D. CH3CH2Br![]() CH2=CH2
CH2=CH2![]() CH2BrCH2Br
CH2BrCH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如下 :
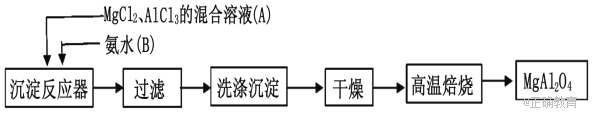
(1)为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应器中加入____________(填“A”或“B”),再滴加另一反应物。
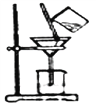
(2)如右图所示,过滤操作中的一处错误是_______________________________。
(3)判断流程中沉淀是否洗净所用的试剂是_____________________________;高温焙烧时,用于盛放固体的仪器名称是________________。
(4)无水AlCl3(183°C升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。
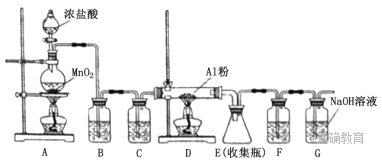
装置 B中盛放饱和NaCl溶液,该装置的主要作用是_________________________。F中试剂的作用是________________;用一件仪器装填适当试剂后也可起到F和G的作用;所装填的试剂为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各反应所对应的方程式正确的是( )
A. Cl2与H2O反应:Cl2+H2O===Cl-+2H++ClO-
B. 向NaNO2溶液中滴加酸性KMnO4溶液:5NO+2MnO+3H2O===5NO+2Mn2++6OH-
C. 向NaHSO4溶液中加入Ba(OH)2溶液至SO![]() 刚好沉淀:H++SO
刚好沉淀:H++SO![]() +Ba2++OH-===BaSO4↓+H2O
+Ba2++OH-===BaSO4↓+H2O
D. 向Ba(OH)2溶液中加入硫酸:Ba2++SO![]() ===BaSO4↓
===BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在离子RO3n-中共有x个核外电子,R原子的质量数A,则R原子核内含有的中子数是( )
A.A-x+n+48B.A-x-n-24C.A-x+n+24D.A+x-n-24
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】初中化学教材中“家庭小实验”是利用家庭日常生活用品进行化学学习和探究的活动。食盐、食醋、纯碱等均为家庭厨房中常用的物质,利用这些物质你能完成的实验是
①检验自来水中是否含氯离子 ②鉴别食盐和纯碱 ③检验鸡蛋壳能否溶于酸 ④除去热水瓶中的水垢
A.①②③④B.②③④C.②④D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学研究中,往往可以通过观察现象认识物质变化的情况。请分析以下一组有现象变化的化学反应。
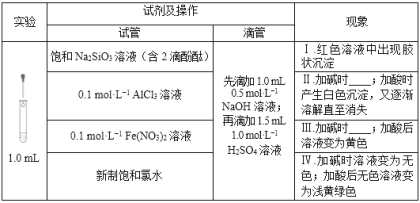
(1)用离子方程式解释现象Ⅰ中出现胶状沉淀的原因:_____________。
(2)Ⅱ中加碱时出现的现象是_______________,此现象说明溶液中发生反应的离子方程式是____________________________________。
(3)Ⅲ中加碱时出现的现象是_____________________________________。
(4)用离子方程式解释Ⅳ中加碱时出现的现象:____________________________________。
(5)滴加试剂顺序的变化,会影响溶液中的现象和发生的反应,请继续分析以下实验。
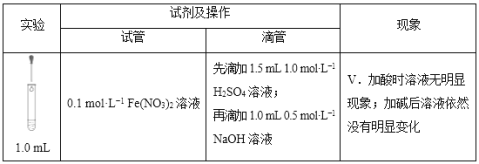
①探究加酸时Fe(NO3)2溶液中是否发生了反应:
向1.0mL 0.1mol/LFe(NO3)2溶液中______________,溶液立即变红,说明溶液中含Fe3+,证明加酸时溶液中发生了反应。
②推测溶液中产生Fe3+的可能原因有两种:
a.酸性条件下,0.1mol/LFe(NO3)2溶液中的Fe2+被NO3-氧化;
b.______________________(用离子方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com