

���� ����������Ҫ�ɷ�Cu2S��Fe2O3�ȣ����շ������巢����ӦCu2S+2O2$\frac{\underline{\;����\;}}{\;}$SO2+2CuO�����Թ���A��CuO��Fe2O3�������ϡ�����ϣ������ķ�ӦΪCuO+H2SO4=CuSO4+H2O��Fe2O3+3H2SO4=Fe2��SO4��3+3H2O���������Feм��������ӦCuSO4+Fe=FeSO4+Cu��2Fe2��SO4��3+Fe=3FeSO4�����Թ���B�ɷ���Fe��Cu����ҺB�ɷ�ΪFeSO4��ͨ���Լ�X�õ���������Һ�����Լ�XΪ����������������Һ�м�����������۵õ���ҺD����������Һ��ͭ��ϡ������Һ��ͨ������������������Һ��ϵ���ҺE����ҺEΪ��������������ͭ�����Һ���ټ�������������������Ϊ�����ӣ�����pH���������ӣ��õ�����ͭ��Һ���Դ˽����⣮
��� �⣺����������Ҫ�ɷ�Cu2S��Fe2O3�ȣ����շ������巢����ӦCu2S+2O2$\frac{\underline{\;����\;}}{\;}$SO2+2CuO�����Թ���A��CuO��Fe2O3�������ϡ�����ϣ������ķ�ӦΪCuO+H2SO4=CuSO4+H2O��Fe2O3+3H2SO4=Fe2��SO4��3+3H2O���������Feм��������ӦCuSO4+Fe=FeSO4+Cu��2Fe2��SO4��3+Fe=3FeSO4�����Թ���B�ɷ���Fe��Cu����ҺB�ɷ�ΪFeSO4��ͨ���Լ�X�õ���������Һ�����Լ�XΪ����������������Һ�м�����������۵õ���ҺD����������Һ��ͭ��ϡ������Һ��ͨ������������������Һ��ϵ���ҺE����ҺEΪ��������������ͭ�����Һ���ټ�������������������Ϊ�����ӣ�����pH���������ӣ��õ�����ͭ��Һ��
��1������������Ҫ�ɷ�Cu2S��Fe2O3�ȣ����շ������巢����ӦCu2S+2O2$\frac{\underline{\;����\;}}{\;}$SO2+2CuO��
�ʴ�Ϊ��Cu2S+2O2 $\frac{\underline{\;����\;}}{\;}$2CuO+SO2��
��2����ҺCͨ������Ũ������ȴ�ᾧ�����˵Ȳ����õ������������壻
�ʴ�Ϊ������Ũ������ȴ�ᾧ��
��3�����������£�������������������Ϊ�����ӣ���������Cu��Ӧ����ͭ�������������ӣ���������������������������ã���������з�Ӧ�ķ���ʽΪ��4FeSO4+O2+2H2SO4=2Fe2��SO4��3+2H2O��Fe2��SO4��3+Cu=CuSO4+2FeSO4����ҺDδ�����仯����������
�ʴ�Ϊ��Fe2��SO4��3+Cu=CuSO4+2FeSO4������
��4������ʱ�����˫��ˮ��Fe2+����ΪFe3+���ټ��Լ�Z������ҺpH�Գ�ȥFe3+�������Լ�YҪ�������������ҿ����������ӷ�Ӧ���Լ�YΪCuO��Cu��OH��2��CuCO3�ȣ�
��Ԫ�ص�����Ũ��С��10-5mol/Lʱ������ȫ����Ksp[Fe��OH��3]=c��Fe3+����c3��OH-��=1.0��10-38���ɵ�c��OH-��=1.0��10-11mol/L����c��H+��=$\frac{1{0}^{-14}}{1{0}^{-11}}$mol/L=1.0��10-3mol/L����ҺpH=-lg1.0��10-3=3��
�ʴ�Ϊ��CuO����Cu��OH��2��CuCO3�ȣ���3��
���� ���⿼�������Ʊ��������̣��漰�Բ������Լ��ķ������ۡ����ʷ����ᴿ���������Ƶȣ�������ѧ���ķ���������ʵ�������Ŀ��飬�ؼ�������ʵ��ԭ���Ͳ������̣���������Ԫ�ػ��������ʣ���Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ķ��--������˵�ԭ�ӽṹģ�� | |
| B�� | ά��--�ϳ�����ʵ�����������л����ת�� | |
| C�� | ����--���ݨ�����ɢ���������ԭ�ӽṹ��������ѧģ�� | |
| D�� | ��°�--�����Ƽ��ԭ���ǽ�����ͨ�������̼���Ȼ��Ʊ�����Һ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 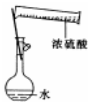 ����һ�����ʵ���Ũ�ȵ�ϡ���� | B�� |  ��ȡ������Fe��OH��3���� | ||
| C�� | 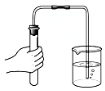 ��������� | D�� |  ����NaOH���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����������Ӧˮ����ļ��Դ�С˳��һ���ǣ�X��Y | |
| B�� | ���Ӱ뾶��ԭ�Ӱ뾶�ɴ�С��˳���ΪX��Y��Z��W | |
| C�� | �⻯����ȶ�����Z��W | |
| D�� | ��ԭ��Z m-��W��m+1��-��������Xn+��Y��n+1��+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ƿʹ��ǰ������ˮ��ϴ��û�и��� | |
| B�� | ���ƹ����У�δ������ˮϴ���ձ��Ͳ����� | |
| C�� | ����ȷ����Һ����̶������� | |
| D�� | �ó�����������NaOH��ʱ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����ӵ���������������ﺬ��4molO | |
| B�� | CH4��Ħ������Ϊ16g | |
| C�� | lmolFe������Ϊ56g/mol | |
| D�� | lmolNH3Ϊ18g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com