
| ��� | �� | �� | �� | ��[�� |
| ��Һ | ��ˮ | ����������Һ | ������Һ | ���� |
| pH | 11 | 11 | 3 | 3 |
| A���ڡ�������Һ��ȣ���Һ��ˮ�ĵ���̶Ȳ�ͬ |
| B��������Һ�ֱ��ˮϡ��10����pH�仯�����Ǣٺ͢� |
| C���١��ڡ����зֱ���������Ĵ���粒����������Һ��pH����С |
| D���١�������Һ��һ������Ȼ�ϣ�������Һ������Ũ�ȵĹ�ϵ�����ڣ�c��H+����c��Cl-����c��OH-����c��NH4+�� |


 ���ƽ̸�������ѡ����ĩ���100��ϵ�д�
���ƽ̸�������ѡ����ĩ���100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| Ԫ�� | A | B | C | D |
| ���ʻ�ṹ��Ϣ | ���ʳ�����Ϊ���壬������ˮ������CS2�����γ�2�ֶ�Ԫ�����ᣮ | ԭ�ӵ�M����1��δ�ɶԵ�p���ӣ�����p������������7�� | ����������Ϊ����ɫ�Ľ��ӡ�������γɵĺϽ����ں������������������ǿ���ǿ� | ԭ�Ӻ�����Ӳ���s����������p����������2�������ʺ��������Ϊ�ռ���״���壬���кܸߵ��ۡ��е㣮 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
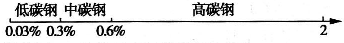
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| Ԫ�� | A | B | C | D |
| ���� �ṹ ��Ϣ |
�����Ƴɵĸ�ѹ�ƣ������Ļƹ�����ǿ�����Զ�� | ��ҵ��ͨ������Һ̬��������䵥�ʣ�ԭ�ӵ������δ�ﵽ�ȶ��ṹ�� | ���ʳ��¡���ѹ�������壬ԭ�ӵ�L����һ��δ�ɶԵ�p���ӣ� | +2�������ӵĺ�������Ų�����ԭ����ͬ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
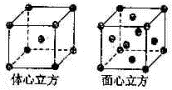 ��2009?����ģ�⣩Mn��Fe��Ϊ�������ڹ���Ԫ�أ���Ԫ�صIJ��ֵ����ܣ�I�����������±���
��2009?����ģ�⣩Mn��Fe��Ϊ�������ڹ���Ԫ�أ���Ԫ�صIJ��ֵ����ܣ�I�����������±���| Ԫ�� | Mn | Fe | |
| ������/kJ?mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ͭ����������ʹ�õĽ��������㷺Ӧ���ڵ������Ṥ����е���������ҵ�ȣ���֪Cu2O��H2SO4�ܷ�����Ӧ��Cu2O+H2SO4=Cu+CuSO4+H2O��
ͭ����������ʹ�õĽ��������㷺Ӧ���ڵ������Ṥ����е���������ҵ�ȣ���֪Cu2O��H2SO4�ܷ�����Ӧ��Cu2O+H2SO4=Cu+CuSO4+H2O��
| ||
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com