

���� ˮ�ܺ�VOSO4������ؿ�����ˮ���������費����ˮ�����˵õ�����Ϊ�������裬��Һ�����л���ȡ������ȡ�õ���VO2+�л��㣬����ȡ�����л���ȡ��������KClO3ʹVO2+����ΪVO3-�����յõ�V2O5��
��1���������費����ˮ�����˵õ�����Ϊ�������裻��������������������Һ��Ӧ�����˹����ƺ�ˮ����Ӧ�����ӷ���ʽΪ��SiO2+2OH-=SiO32-+H2O��
��2������ڡ�������ȡ����Һ��ʹ�õ���Ҫ�����Ƿ�Һ©����������ȡʱ���������������ƽ���е������ӷ�Ӧ�ٽ�ƽ��������У�
��3�����з���ȡʱ�����X�Լ�������ƽ��������У�����ܼ���KClO3ʹVO2+����ΪVO3-����������ԭΪCl-��
��4����������ͼ�����ʲμӷ�Ӧ����Ӧ�����������ɿ���ѭ�����ã�
��� �⣺ˮ�ܺ�VOSO4������ؿ�����ˮ���������費����ˮ�����˵õ�����Ϊ�������裬��Һ�����л���ȡ������ȡ�õ���VO2+�л��㣬����ȡ�����л���ȡ��������KClO3ʹVO2+����ΪVO3-�����յõ�V2O5��
��1��ˮ�ܺ�VOSO4������ؿ�����ˮ���������費����ˮ�����˵õ�����Ϊ�������裬��������������������Һ��Ӧ�����˹����ƺ�ˮ����Ӧ�����ӷ���ʽΪ��SiO2+2OH-=SiO32-+H2O��
�ʴ�Ϊ��SiO2+2OH-=SiO32-+H2O��
��2����ʵ�����в���ڡ�������ȡ����Һ��ʹ�õ���Ҫ�����Ƿ�Һ©�����ʴ�Ϊ����Һ©����
�ڷ���ƽ�⣬Rn+��ˮ�㣩+nHA���л��㣩?RAn���л��㣩+nH+��ˮ�㣩������ļ���к������Ӵٽ�ƽ��������У�����˷�����ȡ�ʣ�
�ʴ�Ϊ������ļ���к������Ӵٽ�ƽ��������У�����˷�����ȡ�ʣ�
��3�����з���ȡʱ�����X�Լ�������ƽ��������У����Լ�����������ƽ��������У�����ܼ���KClO3ʹVO2+����ΪVO3-����������ԭΪCl-����ƽ�����ӷ���ʽΪClO3-+6VO2++9H2O=Cl-+6VO3-+18H+��
�ʴ�Ϊ�����ClO3-+6VO2++9H2O=Cl-+6VO3-+18H+��
��4����������ͼ�����ʲμӷ�Ӧ����Ӧ�����������ɵ����ʣ����ظ����õ����ʿ���ѭ�����ã��������л���ȡ������������ѭ�����ã�
�ʴ�Ϊ���л���ȡ����������
���� ���⿼�������̷����жϣ��������ʺ�ʵ����Ƶķ���Ӧ�ã������Ϣ�����ж����������ջ����ǹؼ�����Ŀ�Ѷ��еȣ�


 ���ɿ��õ�Ԫ������ĩר����100��ϵ�д�
���ɿ��õ�Ԫ������ĩר����100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 Al��Ti��Fe��Cu�Ǽ��ֳ�������Ҫ����������Ҫ��ش��������⣺
Al��Ti��Fe��Cu�Ǽ��ֳ�������Ҫ����������Ҫ��ش��������⣺| Ԫ�� | A | B | |
| �����ܣ�kJ/mol�� | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ˮʱ����Һ��$\frac{c��O{H}^{-}��}{c��N{H}_{3}•{H}_{2}O��}$���� | |
| B�� | �����¶ȣ���Һ��c��NH4+������ | |
| C�� | ��������NaOH���壬ƽ�������ƶ�������ƽ�ⳣ����С | |
| D�� | ��������0.1 mol•L-1�����ᣬ��Һ��c��OH-������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ܢ� | B�� | �٢ڢۢ� | C�� | �٢ڢۢܢ� | D�� | ȫ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ��Ӧʱ��/min | n��CO��/mol | n��H2O��/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A�� | ��Ӧ��t1min�ڵ�ƽ������Ϊv��H2��=$\frac{0.40}{t_1}$mol/��L•min�� | |
| B�� | ���������������䣬��ʼʱ�������г���0.60molCO��1.20molH2O������ƽ��ʱn��CO2��=0.40 mol | |
| C�� | ���������������䣬��ƽ����ϵ����ͨ��0.20molH2O����ԭƽ����ȣ��ﵽ��ƽ��ʱCOת��������H2O�����������С | |
| D�� | �¶�����1000�棬������Ӧƽ�ⳣ��Ϊ1.6��������ӦΪ���ȷ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ������������д����Ӧ���Ȼ�ѧ����ʽ��
������������д����Ӧ���Ȼ�ѧ����ʽ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
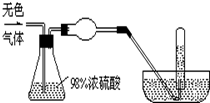 ��һ��ɫ���壨������O2��N2��CO2��HCl��NH3��H2��NO��NO2�е�һ�ֻ�����ɣ������Ϊ100mL����ͼʾͨ��Ũ�����ϴ��ƿ����������������ٵ�һ�룻ͨ�����θ���ܺ�����ʺ���ɫ���ٽ���������ȫͨ��ʢ��ˮ�ҵ�����ˮ�۵��Թ��ڣ����ֵ�����ˮ�۵��Թ��ڵ�ˮλ�½����ֻ�������������Թ���ȫ������Һ�壬�ɴ��жϣ�
��һ��ɫ���壨������O2��N2��CO2��HCl��NH3��H2��NO��NO2�е�һ�ֻ�����ɣ������Ϊ100mL����ͼʾͨ��Ũ�����ϴ��ƿ����������������ٵ�һ�룻ͨ�����θ���ܺ�����ʺ���ɫ���ٽ���������ȫͨ��ʢ��ˮ�ҵ�����ˮ�۵��Թ��ڣ����ֵ�����ˮ�۵��Թ��ڵ�ˮλ�½����ֻ�������������Թ���ȫ������Һ�壬�ɴ��жϣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com