
| A. | 上述反应的热化学方程式为:N2(g)+3H2(g)═2NH3(g)△H=-Q1 kJ/mol | |
| B. | 相同条件下1mol N2(g)和3mol H2(g 的总键能小于2molNH3(g)的总键能 | |
| C. | 相同条件下将2molN2和6molH2置于相同容器中充分反应后放出的热量为Q2 kJ,Q2=2Q1 | |
| D. | 相同条件下气体密度不变时,可以判断反应N2(g)+3H2 (g)═2NH3 (g)达到平衡状态 |
分析 A.该反应为可逆反应,则反应生成的氨气小于2mol,该生成2mol氨气放出的热量大于Q1kJ;
B.放热反应中,反应物总能量大于生成物总能量;
C.相同条件下将2molN2和6molH2置于相同容器中,增大了压强,平衡向着正向移动,则放出的热量大于2Q1;
D.该反应前后都是气体,容器的容积不变,则混合气体的密度始终不变.
解答 解:A.1mol N2和3mol H2充分反应生成NH3放热为Q1kJ,应用该反应为可逆反应,则平衡时生成氨气的物质的量小于2mol,所以生成2mol氨气放出的热量大于Q1kJ,
上述反应的热化学方程式为:N2(g)+3H2(g)═2NH3(g)△H<-Q1 kJ/mol,故A错误;
B.该反应为放热反应,则相同条件下1mol N2(g)和3mol H2(g)的总键能小于2molNH3(g)的总键能,故B正确;
C.相同条件下将2molN2和6molH2置于相同容器中,增大了压强,平衡向着正向移动,生成氨气的物质的量增大,则放出的热量Q2>2Q1,故C错误;
D.反应N2(g)+3H2(g)═2NH3(g)的反应物、生成物都是气体,且容器的容积不变,根据ρ=$\frac{m}{V}$可知,混合气体的密度始终不变,不能根据密度判断平衡状态,故D错误;
故选B.
点评 本题考查较为综合,涉及反应热与焓变、可逆反应特点、平衡状态判断等知识,题目难度中等,明确化学反应与能力变化的关系为解答关键,注意掌握化学平衡及其影响,试题培养了学生的灵活应用能力.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | C57H104O6 | B. | C57H108O6 | C. | C57H106O6 | D. | C57H102O6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Z、W均可形成两种常见氧化物 | |
| B. | 四种元素在自然界均不能以游离态存在 | |
| C. | 元素X、Y、W的最高化合价均与其族序数相等 | |
| D. | 离子半径:W>Z>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体样品于试管中,滴加足量1mol•L-1 H2SO4溶液,然后将内壁附有澄清石灰水的烧杯罩于试管口 | 若澄清石灰水未见浑浊,则假设1成立;若澄清石灰水变浑浊,则假设2或假设3成立 或假设1不成立. |
| 步骤2: | |
| 步骤3: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2CH2CH2Cl | B. | CH3CH2CHClCH2CH3 | ||
| C. | 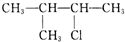 | D. | 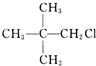 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
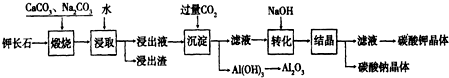
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
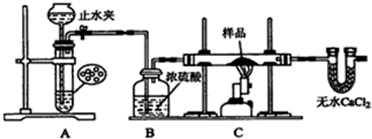
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
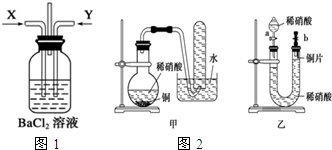 请分析回答某同学在探究浓硫酸、稀硫酸、浓硝酸、稀硝酸分别与铜反应的实验中发生的有关问题.
请分析回答某同学在探究浓硫酸、稀硫酸、浓硝酸、稀硝酸分别与铜反应的实验中发生的有关问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com