
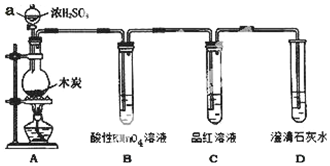
 为了探究木炭与浓H2SO4反应的产物中是否存在CO2,某同学选用如图所示装置进行实验:
为了探究木炭与浓H2SO4反应的产物中是否存在CO2,某同学选用如图所示装置进行实验: .
.分析 A装置:碳和浓硫酸在加热条件下反应C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,生成SO2和CO2,SO2和CO2均能使澄清石灰水变浑浊,因此在用澄清石灰水检验CO2之前必须把SO2吸收干净,B装置:酸性高锰酸钾溶液用于吸收SO2,C装置:品红溶液用于检验SO2是否除干净,D装置:澄清的石灰水检验二氧化碳.
(1)根据图示仪器a的特征以及常见仪器的名称可知,仪器a为分液漏斗,有关气体的检验实验,在组装好上述实验装置后,在装入药品之前必须检验装置的气密性;
(2)A中木炭与浓H2SO4反应生成二氧化碳和二氧化硫和水,实验室制取Cl2,MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,反应中Mn元素的化合价由+4价降低到+2价,Cl元素的化合价由-1价升高到0价,结合氧化还原反应的电子转移知识分析;
(3)酸性高锰酸钾具有强氧化性,可以氧化二氧化硫,因此用酸性高锰酸钾溶液吸收SO2,二氧化碳与酸性高锰酸钾溶液不反应;
(4)品红溶液不褪色,说明SO2除干净,澄清的石灰水变浑浊,即可说明产物中一定存在CO2气体;
(5)根据c=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度,根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器来解答,定容时俯视刻度线,溶液体积V偏小,结合c=$\frac{n}{V}$分析.
解答 解:(1)图示仪器a,具有玻璃活塞,具有球形特征的漏斗,为分液漏斗,该实验的目的探究木炭与浓H2SO4反应的产物中是否存在CO2,所以在组装好上述实验装置后,在装入药品之前必须检验装置的气密性,
故答案为:分液漏斗;检查装置的气密性;
(2)装置A中发生的反应为C和浓硫酸共热生SO2、CO2和水,化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,实验室制取Cl2:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O中,Mn元素的化合价降低,氧化剂为MnO2,MnCl2为还原产物,Cl元素的化合价升高,被氧化,HCl为还原剂,Cl2为氧化产物,则1mol氧化剂反应转移2mol2e-,改写成离子方程式以及用双线桥法表示反应中电子转移的数目为 ,
,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O; ;
;
(3)用澄清石灰水检验CO2之前必须把SO2吸收干净,酸性高锰酸钾具有强氧化性,可以氧化二氧化硫,因此用酸性高锰酸钾溶液除掉SO2,
故答案为:除去混合气体中二氧化硫;
(4)品红溶液不褪色,说明SO2除干净,澄清的石灰水变浑浊,即可说明产物中一定存在CO2气体,即C中品红不褪色,D中溶液出现白色沉淀(或浑浊),
故答案为:C中品红不褪色,D中溶液出现白色沉淀(或浑浊);
(5)质量分数为98%,密度为1.84g/cm3的浓硫酸的物质的量浓度=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,用该硫酸配制500mlL0.5mol/L的稀硫酸,用量筒取用药品,在烧杯中溶解,冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,还需要500mL容量瓶,定容时俯视刻度线,溶液体积V偏小,c=$\frac{n}{V}$可知,n不变,V偏小,则c偏大,
故答案为:18.4mol/L; 500 mL容量瓶;偏大.
点评 本题考查了探究木炭与浓H2SO4反应,为高频考点,侧重于SO2和CO2性质的比较,SO2和CO2均能使澄清石灰水变浑浊,因此在用澄清石灰水检验CO2之前必须把SO2吸收干净,试题有利于培养学生的良好的科学素养,提高学生学习实验的积极性,题目难度中等.


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
A | 晶体硅熔点髙硬度大 | 可用于制作半导体材料 |
| B | 常温下铁与浓硫酸不反应 | 可用铁槽车密封运送浓硫酸 |
| C | NH4HCO3受热易分解 | 可用作氮肥 |
| D | HF与SiO2反应 | 氢氟酸在玻璃器皿上刻蚀标记 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、NH4+、SCN-、Cl- | B. | Na+、Mg2+、NO3-、SO42- | ||
| C. | Al3+、Fe2+、NO3-、Cl- | D. | K+、Na+、Cl-、SiO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
| A | 烧碱 | H2SO4 | BaCO3 | Na2O2 | CO2 |
| B | Ba(OH)2 | HCl | NaCl | Na2O | CO |
| C | 纯碱 | CH3COOH | CaCl2 | Al2O3 | SO2 |
| D | KOH | HClO | CaCO3 | CaO | SiO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当V(CO2)≤0.56L时,发生的离子反应式为CO2+Ba2++2OH-═BaCO3↓+H2O | |
| B. | 当V(CO2)>1.68L时,发生的离子反应式为BaCO3+H2O+CO2═Ba2++HCO3- | |
| C. | NaOH的物质的量浓度为0.05mol•L-1 | |
| D. | 当V(CO2)=1.96L时,BaCO3与Ba(HCO3)2的物质的量之比为2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com