
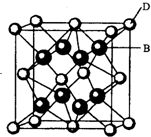
 有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对的单电子,F原子核外电子数是B与C核外电子数之和,D是主族元素且与E同周期,E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物,D与B可形成离子化合物其晶胞结构如右图所示.请回答下列问题.
有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对的单电子,F原子核外电子数是B与C核外电子数之和,D是主族元素且与E同周期,E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物,D与B可形成离子化合物其晶胞结构如右图所示.请回答下列问题.| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| 6-1×2 |
| 2 |
| 5+1-2×2 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| m |
| V |
| 78×4 | ||
|
| 4×78g?mol-1 |
| ag?cm-3×6.02×1023mol-1 |
| 4×78g?mol-1 |
| ag?cm-3×6.02×1023mol-1 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
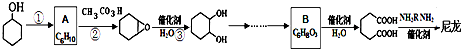
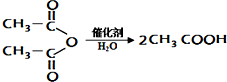
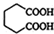 合成尼龙的化学方程式为
合成尼龙的化学方程式为查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | A | B | C |
| 合金质量/mg | 510 | 765 | 918 |
| 气体体积/mL | 560 | 672 | 672 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.8×10-7mol/L |
| B、1.8×10-8 mol/L |
| C、1.8×10-9mol/L |
| D、1.8×10-10mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、燃着的酒精灯不慎碰翻失火,应该迅速用湿抹布扑盖 |
| B、用电子天平称量化学药品时,必须先称小烧杯的质量,再称量加入试剂后的总质量,两者之差即为药品的质量 |
| C、制备摩尔盐的过程中,洗涤硫酸亚铁铵晶体时,应用少量酒精洗去晶体表面附着的水分 |
| D、在适量氯化钴的乙醇溶液中,逐滴加入水至溶液恰好呈粉红色,加热该溶液,结果依次呈现紫色、蓝紫色、蓝色的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蛋白质、棉花、核酸、PVC、淀粉都是由高分子组成的物质 |
| B、合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺 |
| C、红外光谱仪、核磁共振、质谱仪、分光光度计都可用于有机化合物官能团结构的分析 |
| D、造成大气污染的SO2、CO和NO,主要来源于化石燃料的燃烧和汽车尾气的排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作及现象 | 实验目的或结论 | |
| A | 用洁净的铂丝蘸取溶液进行焰色反应,火焰呈黄色 | 原溶液中有Na+,无K+ |
| B | 向醋酸钠溶液中滴入酚酞试液,加热后若红色加深 | 证明盐类的水解是吸热反应 |
| C | 将SO2通入KMnO4(H+)溶液中 | 验证SO2具有漂白性 |
| D | 硅酸钠溶液中滴入酚酞,溶液变红,再滴加稀盐酸,溶液红色变浅直至消失 | 证明非金属性:Cl>Si |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、(NH4)2SO4和CuSO4溶液都能使蛋白质沉淀析出 |
B、苯酚与甲醛在酸性条件下生成酚醛树脂的结构简式为 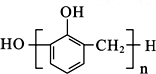 |
| C、醋酸和硬脂酸互为同系物,C6H14和C9H20也一定互为同系物 |
D、迷迭香酸的结构为 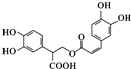 它可以发生酯化、水解、加成等反应 它可以发生酯化、水解、加成等反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某些金属化合物具有特定的颜色,因此可制作烟花 |
| B、H2O2是一种绿色氧化剂,可氧化酸性高锰酸钾而产生O2 |
| C、铜的金属活动性比铁弱,可用铜罐代替铁罐贮运浓硝酸 |
| D、酶催化反应具有高效、专一、条件温和等特点,化学模拟生物酶对绿色化学、环境保护及节能减排具有重要意义 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com