
| A. | 铜丝在空气中灼烧后迅速伸入乙醇蒸气中 | |
| B. | 铁粉与硫粉物质的量之比为1:1时混合加热 | |
| C. | 锌粉加入到氯化铜溶液中 | |
| D. | 去除氧化膜的铝条插入到浓硝酸中 |
分析 A、铜灼烧生成了氧化铜,氧化铜和乙醇反应生成了乙醛和铜;
B、铁粉与硫粉反应生成硫化亚铁;
C、锌和硫酸铜发生置换反应生成铜和硫酸锌,固体质量减小;
D、铝在浓硝酸中常温下发生钝化,氧化铝是两性氧化物溶于浓硝酸.
解答 解:A、由于氧化铜能够和乙醇反应生成乙醛和铜,铜变成氧化铜,氧化铜又被还原成铜,最终铜质量没有变化,故A错误;
B、铁粉与硫粉反应生成硫化亚铁,铁粉与硫粉物质的量之比为1:1时恰好反应生成硫化亚铁,反应物质量不变,故B错误;
C、锌和硫酸铜发生置换反应生成铜和硫酸锌,Zn+Cu2+=Cu+Zn2+,固体质量减小,故C错误;
D、铝在浓硝酸中常温下发生钝化,氧化铝是两性氧化物溶于浓硝酸,去除氧化膜的铝条可以插入到浓硝酸中,故D正确;
故选D.
点评 本题考查了物质性质的分析判断,注意反应前后固体质量的变化分析,掌握常温下铝在浓硝酸中钝化和化学基础是关键,题目较简单.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子及其离子的核外电子层数等于该元素所在的周期数 | |
| B. | 元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素 | |
| C. | 所含质子数和电子数都相同的粒子一定是分子 | |
| D. | 同一元素的各种同位素的物理性质、化学性质均相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
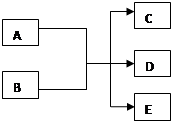 在一定条件下,某些化学反应可以如图框架表示(未注明反应条件),根据要求回答下列问题:
在一定条件下,某些化学反应可以如图框架表示(未注明反应条件),根据要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| Fe3+ | Fe2+ | Cu2+ | |
| 开始沉淀的pH | 1.9 | 7.0 | 4.7 |
| 完全沉淀的pH | 3.2 | a | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
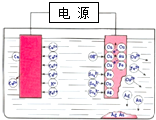
| A. | 右边电极材料为精铜 | |
| B. | 电解质溶液可选择CuSO4溶液 | |
| C. | 随着电解的进行,溶液中Cu2+浓度逐渐增加 | |
| D. | 阳极质量的减小量等于阴极质量的增加量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com