
| A. | 吸热反应 | B. | 离子反应 | C. | 复分解反应 | D. | 非氧化还原反应 |
分析 碳单质和二氧化碳气体反应生成一氧化碳气体,化学方程式为:C+CO2$\frac{\underline{\;高温\;}}{\;}$2CO,据此分析.
解答 解:碳单质和二氧化碳气体反应生成一氧化碳气体,化学方程式为:C+CO2$\frac{\underline{\;高温\;}}{\;}$2CO.
A、此反应时以C为还原剂的氧化还原反应,故为吸热反应,故A正确;
B、此反应无离子参加或生成,故不是离子反应,故B错误;
C、复分解反应是两种化合物相互交换成分生成另外两种化合物的反应,此反应不是复分解反应,故C错误;
D、此反应有化合价的变化,故为氧化还原反应,故D错误.
故选A.
点评 本题考查了常见反应的属类,注意掌握常见化学概念是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 通常状况下,NA 个CO2分子占有的体积为22.4L | |
| B. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA | |
| C. | 标准状况下,22.4LH2O含有的分子数为 NA | |
| D. | 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑥③②④①⑤ | B. | ⑤④③①②⑥ | C. | ⑥③①②④⑤ | D. | ②③①④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
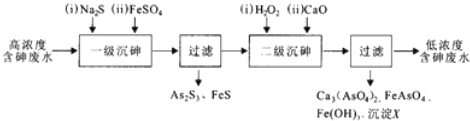
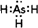
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
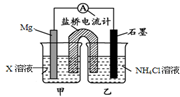
| A. | 盐桥中的K+移向乙烧杯 | |
| B. | 乙烧杯中一直存在:c(Cl-)>c(NH4+) | |
| C. | X可能是CuCl2 | |
| D. | 石墨电极反应式为2NH4++2e-═2NH3↑+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2与O3互为同素异形体 | B. | 16O与18O核外电子排布不同 | ||
| C. | 麦芽糖与蔗糖互为同分异构体 | D. | CH3CH3与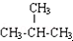 互为同系物 互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作、现象 | 结 论 | |
| A | 火柴梗上滴少量的浓硫酸;火柴梗变黑 | 浓硫酸具有强氧化性 |
| B | 含锈的铁浸泡在NH4Cl溶液中,铁锈逐渐溶解 | NH4Cl显酸性 |
| C | Ba(NO3)2溶液中通入SO2气体;产生白色沉淀 | BaSO3难溶 |
| D | 某无色溶液中通入过量的CO2气体,有白色沉淀 | 一定含有AlO2- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
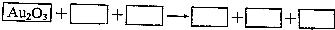

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
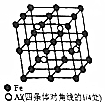 铝、铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:
铝、铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题: .
. ,C、N、O三种元素的电负性由大到小的顺序为O>N>C.
,C、N、O三种元素的电负性由大到小的顺序为O>N>C.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com