
| A. | 新制碱性Cu(OH)2悬浊液 | B. | FeCl3溶液 | ||
| C. | BaCl2溶液 | D. | 酸性KMnO4溶液 |
分析 乙醇和FeCl3溶液无明显现象,苯酚和FeCl3溶液显紫色,甲苯不溶于水,AgNO3溶液和FeCl3溶液有白色沉淀,KOH溶液和FeCl3溶液有红褐色沉淀,Na2CO3溶液和FeCl3溶液发生相互促进水解反应生成沉淀和气体,现象各不相同,以此来解答.
解答 解:A.乙醇、Na2CO3溶液、KOH溶液等不与新制碱性Cu(OH)2悬浊液反应,现象相同,不能鉴别,故A不选;
B.乙醇和FeCl3溶液无明显现象,苯酚和FeCl3溶液显紫色,甲苯不溶于水,AgNO3溶液和FeCl3溶液有白色沉淀,KOH溶液和FeCl3溶液有红褐色沉淀,Na2CO3溶液和FeCl3溶液发生相互促进水解反应生成沉淀和气体,现象各不相同,可鉴别,故B选;
C.乙醇、苯酚、KOH溶液等不与氯化钡溶液反应,Na2CO3溶液、AgNO3溶液均与氯化钡反应生成白色沉淀,现象相同,不能鉴别,故C不选;
D.乙醇、甲苯、苯酚均可被酸性高锰酸钾氧化,使其褪色,现象相同,不能鉴别,故D不选;
故选B.
点评 本题考查物质的鉴别和检验,为高频考点,把握物质的性质、发生的反应等为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 有X、Y、W三种元素组成的化合物中既有离子键又有非极性共价键 | |
| B. | 简单离子半径由大到小的顺序是:Z>W>Y>X | |
| C. | 简单氢化物的沸点:W>Z,还原性:W>Z | |
| D. | Y、Z、W三元素形成的两种常见化合物的溶液中,水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12g 金刚石中含有的六元碳环数为NA | |
| B. | 1L1mol/L 的甲醇水溶液中含有氢原子总数为4NA | |
| C. | 12g 石墨和 C60的混合物中质子总数为6NA | |
| D. | 反应 KIO3+6HI=KI+3H2O+3I2中,生成1molI2转移电子的总数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯盐酸、空气、硫酸、干冰 | B. | 蒸馏水、氨水、氯化钠、二氧化硫 | ||
| C. | 胆矾、盐酸、铁、碳酸钙 | D. | 生石灰、漂白粉、氯化铜、碳酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素Y的最高正化合价为+6 | B. | 离子半径的大小顺序为W>Q>Z>X>Y | ||
| C. | 工业上用电解法冶炼Z单质 | D. | 元素Q的含氧酸的酸性一定比W的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇、乙酸和乙酸乙酯能用饱和碳酸钠溶液鉴别 | |
| B. | 乙醇和乙酸中都存在碳氧双键 | |
| C. | 常温下,Imol乙醇可与足量的金属钠反应生成11.2L氢气 | |
| D. | 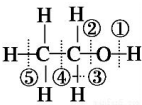 己知乙醇的结构式如图所示,则乙醇催化氧化时断裂的化学键为②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com