
分析 根据n=$\frac{m}{M}$计算二氧化碳、水的物质的量,再根据原子守恒确定该有机物分子中含有的碳氢原子数,从而得出其分子式.
解答 解:在标准状况下,某气态烃的密度是1.34g•L-1,则气态烃的摩尔质量=1.34g/L×22.4L/mol=30g/mol,即该烃的相对分子质量为30,
0.1mol该气体充分燃烧生成8.8g二氧化碳和5.4g水,生成水的物质的量为:$\frac{5.4g}{18g/mol}$=0.3mol,
8.8g二氧化碳的物质的量为:$\frac{8.8g}{44g/mol}$=0.2mol,
该烃分子中含有C、H原子数为:N(C)=$\frac{0.2mol}{0.1mol}$=2、N(H)=$\frac{0.3mol×2}{0.1mol}$=6,
则烃的分子式为C2H6,该烃的相对分子质量为30,与计算结果相符,
故答案为:C2H6.
点评 本题考查了有机物分子式的确定,题目难度中等,明确质量守恒定律在确定有机物分子式中的应用方法,试题侧重基础知识的考查,有利于培养学生灵活应用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:选择题
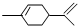 ),下列有关它的推测不正确的是( )
),下列有关它的推测不正确的是( )| A. | 分子中有10个C原子 | |
| B. | 与过量溴的CCl4 溶液反应后产物(右图)为: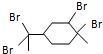 | |
| C. | 能发生加聚反应 | |
| D. | 常温下呈液态难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
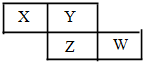 X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如下图所示.若Y原子的最外层电子是 k层电子数的3倍,下列说法不正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如下图所示.若Y原子的最外层电子是 k层电子数的3倍,下列说法不正确的是( )| A. | 氢化物的熔、沸点:H2Y>H2Z | |
| B. | 元素X、Z的最高价氧化物对应的水化物都是强酸 | |
| C. | W元素的阴离子与Ar原子具有相同的电子层结构 | |
| D. | X与Y形成的化合物都易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 元素周期表共有七个周期 | |
| B. | 元素周期表共有18个族 | |
| C. | 所含元素种数最多的族是 VIII族 | |
| D. | 第三周期元素的原子核外都有三个电子层 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

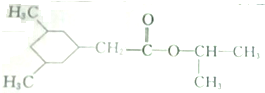 )的线路如下:
)的线路如下:
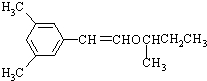 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
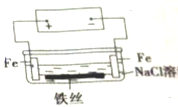
| A. | 原理图可理解为两个串联电解装置 | |
| B. | 溶液中铁丝被腐蚀时,左侧有无色气体产生,附近产生少量白色沉淀,随后变为灰绿色 | |
| C. | 溶液中铁丝左端电极反应式为:Fe-2e-═Fe2+ | |
| D. | 地下管线被腐蚀,不易发现,维修也不便,故应将埋在地下的金属管道表面涂绝缘膜(或油漆等) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com