
| Fe2+ | Fe3+ | Mn2+ | |
| 开始沉淀的pH | 7.5 | 3.2 | 8.8 |
| 完全沉淀的pH | 9.7 | 3.7 | 10.4 |
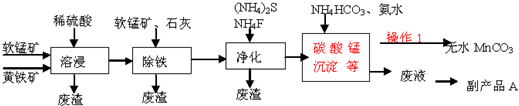
分析 由流程可知软锰矿(主要成分MnO2)和黄铁矿加入硫酸酸浸过滤得到浸出液调节溶液PH,使铁离子全部沉淀,过滤得到浸出液中主要含有Cu2+、Ca2+等杂质,加入硫化铵和氟化铵,除去Cu2+、Ca2+过滤,在滤液中加入碳酸氢铵和氨水过滤得到混合溶液加热赶出氨气结晶析出得到硫酸铵,滤渣为碳酸锰,通过洗涤、烘干得到硫酸锰晶体,
(1)升高温度、搅拌、减小固体的颗粒等均能加速固体的溶解,据此分析;
(2)FeS2与MnO2反应后生成Fe3+、Mn2+和SO42-,1molFeS2失去15mol电子,1molMnO2得到2mol电子,根据得失电子守恒、原子守恒和电荷守恒分析配平;
(3)经过滤、洗涤烘干等过程可得到无水碳酸锰;
(4)①二价铁离子有还原性;②根据三价铁离子沉淀的pH范围判断;
(5)根据溶液中含有的离子分析副产品的主要成分;
(6)发生反应:4FeCO3+O2 2Fe2O3+4CO2,根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减,构造目标热化学方程式.
解答 解:软锰矿(主要成分MnO2)和黄铁矿加入硫酸酸浸过滤得到浸出液调节溶液PH,使铁离子全部沉淀,过滤得到浸出液中主要含有Cu2+、Ca2+等杂质,加入硫化铵和氟化铵,除去Cu2+、Ca2+过滤,在滤液中加入碳酸氢铵和氨水过滤得到混合溶液加热赶出氨气结晶析出得到硫酸铵,滤渣为碳酸锰,通过洗涤、烘干得到硫酸锰晶体,
(1)升高温度、搅拌、减小固体的颗粒等均能加速固体的溶解,所以为了提高溶浸工序中原料的浸出效率,可以采取的措施有:适当升高温度,搅拌,研磨矿石,
故答案为:ABC;
(2)FeS2与MnO2反应后生成Fe3+、Mn2+和SO42-,1molFeS2失去15mol电子,1molMnO2得到2mol电子,根据得失电子守恒,FeS2的计量数为2,MnO2的计量数为15,则生成的Fe3+计量数为2,SO42-的计量数为4,Mn2+的计量数为15,根据电荷守恒可知反应物中有H+,根据原子守恒可知生成物有H2O;所以离子方程式配平为:
2FeS2+15MnO2+28H+=2Fe3++14H2O+15Mn2++4SO42,
故答案为:28H+;2;15;4;14H2O;
(3)过滤分离不溶物和可溶性杂质,经过滤、洗涤烘干等过程可得到无水碳酸锰,故答案为:过滤;洗涤;
(4)①二价铁离子有还原性,能使酸性高锰酸钾溶液褪色,故答案为:加入酸性高锰酸钾溶液,观察是否褪色;
②由表中数据可知三价铁离子完全的沉淀的PH为3.7,铜离子开始沉淀的范围为5.2,所以加入石灰调节溶液的pH的范围为3.7~5.2,故答案为:3.7~5.2;
(5)溶浸过程中发生的反应生成硫酸根离子,后来又加入了硫化铵、碳酸氢铵,所以产品中含有(NH4)2SO4,
故答案为:(NH4)2SO4;
(6)发生反应:4FeCO3+O22Fe2O3+4CO2,
已知:①4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1648kJ/mol
②C(s)+O2(g)═CO2(g)△H=-393kJ/mol
③2Fe(s)+2C(s)+3O2(g)═2FeCO3(s)△H=-1480kJ/mol
根据盖斯定律,①-③×2+②×4可得4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g),故△H=-1648kJ/mol-2×(-1480kJ/mol)+4×(-393kJ/mol)=-260kJ/mol,
故反应热化学方程式为:4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260kJ/mol,
故答案为:4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260kJ/mol.
点评 本题以工业流程图为依托,考查了实验条件的选择、离子方程式的书写、反应热的计算等,题目难度中等,解题关键是合理分析题中生成流程及表中离子完全沉淀时的数据的含义,试题培养了学生分析、理解能力及灵活应用所学知识的能力.


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:解答题
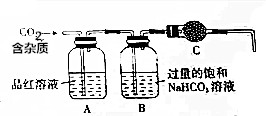 实验室用大理石(主要成分为CaCO3,另外含有少量的CaSO3)和稀盐酸反应制备CO2气体,如图装置可用于杂质气体的检验和CO2气体的提纯、干燥.回答下列问题:
实验室用大理石(主要成分为CaCO3,另外含有少量的CaSO3)和稀盐酸反应制备CO2气体,如图装置可用于杂质气体的检验和CO2气体的提纯、干燥.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | H2燃烧生成1 mol H2O(g)时,放出241.8 kJ的热量 | |
| B. | 1 mol液态水变成水蒸气时吸收44 kJ的热量 | |
| C. | 1mol物质完全燃烧生成稳定氧化物时放出的热量为燃烧热,H2的燃烧热为-285.8 kJ•mol-1 | |
| D. | O2前面的表示参加反应的O2的分子数目 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | n (CO)/mol | n (Cl2)/mol |
| 0 | 1.20 | 0.60 |
| 1 | 0.90 | |
| 2 | 0.80 | |
| 4 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,11.2L N2含有的分子数为0.5NA | |
| B. | 在常温常压下,1mol 氖气含有的原子数为2NA | |
| C. | 27g Al与足量的盐酸反应失去的电子数为3NA | |
| D. | 在同温同压时,相同体积的任何气体单质所含的原子数一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①③ | B. | 只有②④ | C. | 只有①②③④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中性溶液的AG=1 | |
| B. | 常温下0.1 mol•L-1NaOH溶液的AG=12 | |
| C. | 酸性溶液的AG<0 | |
| D. | 常温下0.1 mol•L-1盐酸溶液的AG=12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
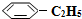 )可生产塑料单体苯乙烯(
)可生产塑料单体苯乙烯(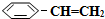 ),其原理反应是:
),其原理反应是: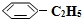 (g)?
(g)?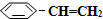 (g)+H2(g)△H=+125kJ•mol-1.
(g)+H2(g)△H=+125kJ•mol-1.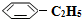 (g)充入2L真空密闭容器中发生反应,测定该容器内的物质,得到数据如下表:
(g)充入2L真空密闭容器中发生反应,测定该容器内的物质,得到数据如下表:| 时间/min | 0 | 10 | 20 | 30 | 40 |
n(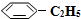 )/mol )/mol | 0.40 | 0.30 | 0.26 | n2 | n3 |
n(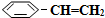 )/mol )/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
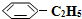 (g)的平衡转化率与水蒸气的用量、体系总压强的关系如图1所示.当其它条件不变时,水蒸气的用量越大,平衡转化率将越大(填“越大”、“越小”或“不变”),原因是体系总压强一定时,水蒸气的分压越大,平衡体系的分压越小,平衡向气体体积增大的方向移动
(g)的平衡转化率与水蒸气的用量、体系总压强的关系如图1所示.当其它条件不变时,水蒸气的用量越大,平衡转化率将越大(填“越大”、“越小”或“不变”),原因是体系总压强一定时,水蒸气的分压越大,平衡体系的分压越小,平衡向气体体积增大的方向移动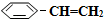 (g)和H2(g),假设在40min时达到上述同样的平衡状态,请在图2中画出并标明该条件下
(g)和H2(g),假设在40min时达到上述同样的平衡状态,请在图2中画出并标明该条件下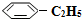 (g)和
(g)和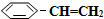 (g)的浓度c随时间t变化的曲线.
(g)的浓度c随时间t变化的曲线.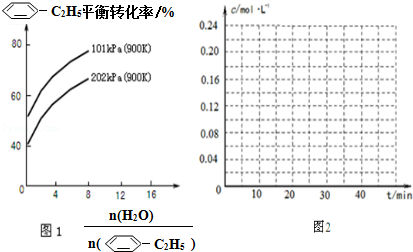
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com