
| 3 |
| 2 |
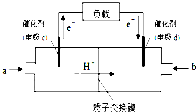

| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| ||
| ||
 ,
, .
.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分散系只包括溶液和胶体 |
| B、电解质和非电解质构成所有的物质 |
| C、相同体积的两溶液,物质的量浓度大的溶液含有溶质的质量就越大 |
| D、单位物质的量的物质所具有的质量叫摩尔质量,摩尔质量与1mol物质的质量数值相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、262.6 kJ?mol-1 |
| B、-131.3 kJ?mol-1 |
| C、-352.3 kJ?mol-1 |
| D、131.3 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、容器内气体密度保持不变 |
| B、v正(N2)=3 v逆(H2) |
| C、混合气体平均相对分子质量不变 |
| D、氨气的浓度是氮气浓度的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、取5mL 0.1mol/L KI溶液,滴加0.1mol/L FeCl3溶液5~6滴,继续加入2mL CCl4,充分振荡,取上层溶液,滴加KSCN溶液,溶液呈现血红色,证明溶液中还存在Fe3+ |
| B、在铁钉的析氢腐蚀实验中,在负极周围加入K3[Fe(CN)6]溶液会出现蓝色沉淀 |
| C、燃料电池实验中,用KNO3溶液或Na2SO4溶液代替蒸馏水,效果要好得多 |
| D、蔗糖的“黑面包”实验中只体现了浓硫酸的脱水性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com