
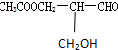 有光学活性,此分子中手性碳原子数目( )
有光学活性,此分子中手性碳原子数目( )| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②⑥ | C. | ③④ | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
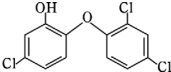 一种化学名为 2,4,4-三氯-2 羟基-二苯醚的物质(如图),被广泛应用于肥皂、牙膏等日用化学品之中,有杀菌消毒等作用.则下列有关说法中正确的是( )
一种化学名为 2,4,4-三氯-2 羟基-二苯醚的物质(如图),被广泛应用于肥皂、牙膏等日用化学品之中,有杀菌消毒等作用.则下列有关说法中正确的是( )| A. | 该物质苯环上的一溴取代物有 6 种 | |
| B. | 该物质与 FeCl3溶液混合后不显色 | |
| C. | 该物质中所有原子一定处于同一平面 | |
| D. | 物质的分子式为 C12H6Cl3O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度过高对合成氨不利 | |
| B. | 合成氨在高压下进行是有利的 | |
| C. | 高温及加入催化剂都能使合成氨的反应速率加快 | |
| D. | 增加N2的浓度可提高平衡混合物中NH3的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.
为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
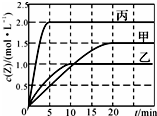 向甲、乙、丙三个容积固定不变的密闭容器中充入一定量的X和Y,一定条件下发生反应 X(g)+aY(g)?2Z(g).各容器的反应温度、反应物起始量、反应过程中Z的浓度随时间变化分别以如图和下表来表示.下列说法不正确的是( )
向甲、乙、丙三个容积固定不变的密闭容器中充入一定量的X和Y,一定条件下发生反应 X(g)+aY(g)?2Z(g).各容器的反应温度、反应物起始量、反应过程中Z的浓度随时间变化分别以如图和下表来表示.下列说法不正确的是( ) | 容器 | 甲 | 乙 | 丙 | |
| 容积/L | 0.5 | 0.5 | 1.0 | |
| 温度/℃ | T1 | T2 | T2 | |
| 反应物起始量 | 1.0 mol X 0.5 mol Y | 1.0 mol X 0.5 mol Y | 4.0 mol X 2.0 mol Y |
| A. | 该反应温度升高,平衡常数减小 | |
| B. | 20 min内甲容器中反应的平均速率:v(X)=0.0375mol•(L•min)-1 | |
| C. | 10 min时,其他条件不变,向乙容器中再加入2 mol Z,平衡向逆反应方向移动 | |
| D. | 其他条件不变,若缩小乙的体积,Y的转化率增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com