
| A. | n1>n2 | B. | n1=n2 | C. | n2>n1 | D. | c(F-)<c(CN-) |
分析 HF的酸性比HCN的酸性强,HF的电离程度大于HCN,则其酸根离子水解程度F-<CN-,相同温度下,物质的量浓度和体积均相同的NaF和NaCN两种溶液中两种盐的物质的量相等,溶液中存在电荷守恒和物料守恒,根据电荷守恒判断.
解答 解:HF的酸性比HCN的酸性强,HF的电离程度大于HCN,则其酸根离子水解程度F-<CN-,相同温度下,物质的量浓度和体积均相同的NaF和NaCN两种溶液中两种盐的物质的量相等,
根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(F-)、c(Na+)+c(H+)=c(OH-)+c(CN-),两种溶液中离子浓度分别是其溶液中所有阳离子浓度的2倍,
因为酸根离子水解程度F-<CN-,则c(F-)>c(CN-),所以NaF溶液中氢离子浓度大于NaCN,两种溶液中钠离子浓度相等,
所以NaF溶液中离子个数大于NaCN离子个数,即n1>n2,
故选A.
点评 本题以离子个数比较为载体考查了盐类水解,题目难度中等,明确电离平衡常数与酸根离子水解程度的关系是解本题关键,然后再采用电荷守恒、离子代换等方法来分析解答.


 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:解答题
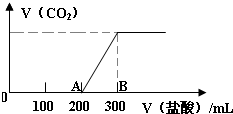 向100mL 3mol/L的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的PH>7.
向100mL 3mol/L的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的PH>7.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 悬浊液的分散质可用过滤的方法从分散剂中分离出来 | |
| B. | 分散质粒子直径为1-100纳米的分散系是胶体 | |
| C. | 相同温度下同一种溶质的饱和溶液要比不饱和溶液的浓度大一些 | |
| D. | 任何物质在水中溶解都有一定的溶解度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱溶液可去除油污 | |
| B. | 用NaHCO3溶液和Al2(SO4)3溶液可以制作泡沫灭火剂 | |
| C. | TiCl4溶于大量水加热制备TiO2 | |
| D. | 用锌粒与稀硫酸反应制取氢气时滴加少量CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第二周期ⅤA族 | B. | 第三周期ⅣA族 | C. | 第三周期ⅥA族 | D. | 第三周期ⅦA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用过滤的方法可以除去Fe(OH)3胶体中的FeCl3 | |
| B. | Fe(OH)3胶体和Fe(OH)3沉淀中粒子的大小相同 | |
| C. | 用丁达尔效应可以区分Fe(OH)3胶体和FeCl3溶液 | |
| D. | 将FeCl3溶液中滴入NaOH溶液中,制备Fe(OH)3胶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com