
【题目】氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品并精制流程:

依照上述流程回答以下问题:
(1)混合①中发生反应的化学方程式为_______。
(2)操作Ⅱ和操作Ⅲ的名称分别是_______、_______。操作Ⅲ一般适用于分离____________混合物。〔选填编号〕
a、固体和液体b、固体和固体c、互不相溶的液体d、互溶的液体
(3)混合②中加入Na2SO3的目的是_______。
(4)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸〔工业氢溴酸〕带有淡淡的黄色。因此甲乙两同学设计了简单实验加以探究:甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,那么用于证明该假设所用的试剂的名称为_______。乙同学假设工业氢溴酸呈淡黄色是因为________,其用于证明该假设所用的试剂的化学式_______。
【答案】SO2+Br2+2H2O==2HBr+H2SO4 过滤 蒸馏 d 除去粗品中未反应完的溴 硫氰化钾溶液 含有Br2 CCl4
【解析】
根据流程图分析分析流程发生的反应,根据混合物性质的不同分析流程中物质分离的方法;根据氧化还原原理分析流程中涉及的氧化还原反应;根据常见离子检验方法分析解答。
混合①中发生反应SO2+Br2+2H2O=H2SO4+2HBr,经操作Ⅰ蒸馏得硫酸和氢溴酸的粗品(含溴),混合②中加入Na2SO3还原粗品中的Br2,但会反应生成SO42,加入氢氧化钡后过滤得硫酸钡沉淀和无色溶液,再蒸馏得到精制的氢溴酸;
(1)Br2具有强氧化性,在溶液中将SO2氧化为H2SO4,自身被还原为HBr,反应方程式为SO2+Br2+2H2O=H2SO4+2HBr;
(2)由工艺流程可知,操作Ⅱ分离固体与液体,应是过滤;操作Ⅲ为互溶的溶液组分的分离,应是蒸馏,蒸馏一般适用于沸点不同的互溶的液体的分离,故答案为:过滤;蒸馏;d;
(3)粗品中可能含有为反应的Br2,加入Na2SO3,除去粗品中未反应完的溴,故答案为:除去粗品中未反应完的溴;
(4)用KSCN溶液检验Fe3+,取少许溶液滴加KSCN溶液,溶液变成血红色,说明氢溴酸呈淡黄色是因为含Fe3+;由工艺流程可知,溶液中可能含有Br2,可以用CCl4萃取方法检验,取少许溶液加振荡、静置分层,下层呈橙红色,说明氢溴酸呈淡黄色是因为含Br2,故答案为:KSCN溶液;含有Br2;CCl4。


科目:高中化学 来源: 题型:
【题目】某温度时,AgCl(s)=Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )

A. 加入AgNO3可以使溶液由c点变到d点
B. 加入固体NaCl,则AgCl的溶解度减小,Ksp也减小
C. d点有AgCl沉淀生成
D. a点对应的Ksp小于b点对应的Ksp
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下图所示装置制备干燥纯净的氯气,并进行氯气的性质实验。下列说法中不正确的是

A.装置C的作用是除去氯气中的杂质HCl
B.装置F中的现象为有白色沉淀产生
C.实验结束时,应先熄灭酒精灯,再将导管移出装有液体的集气瓶或烧杯
D.该实验中体现了浓盐酸的还原性和酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用100mLNaOH溶液捕获CO2,一定时间后,测定CO2的吸收量。充分反应后,再向所得溶液中逐滴加入2.0mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。回答下列问题:

(1)原NaOH溶液的物质的量浓度为______;
(2)题中通入CO2后所得溶液中的溶质有______,溶液中溶质的物质的量之比为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是
A. 原子半径:r(W) > r(Z) > r(Y)
B. 由X、Y 组成的化合物中均不含共价键
C. Y 的最高价氧化物的水化物的碱性比Z的弱
D. X 的简单气态氢化物的热稳定性比W的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是元素周期表的一部分,A、B、C、D、E、X是周期表给出元素组成的常见单质或化合物。
① | |||||||||||||||||
④ | ⑤ | ⑥ | |||||||||||||||
② | ③ | ⑦ | |||||||||||||||
Fe | As | ||||||||||||||||
I、元素周期表是人们研究物质性质的重要工具。Y由②⑥⑦三种元素组成,它的水溶液是生活中常见的消毒剂。As可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为_______,当消耗1mol还原剂时,转移的电子个数为_______。
Ⅱ、A、B、C、D、E、X存在如下图转化关系〔部分生成物和反应条件略去〕。

(1)假设E为氧化物,那么A与水反应的化学方程式为_______。
①当X是碱性盐溶液,C分子中有22个电子时,那么C的电子式为_______。
②表示
③当X为金属单质时,那么X与B的稀溶液反应生成C的离子反应方程式为_______。
(2)假设E为单质气体,D为白色沉淀,B含有的化学键类型为_______,C与X反应的离子方程式为_______。
(3)①和⑤形成的化合物是一种可燃性液体,其燃烧产物之一是大气中的要紧成分,1.6克该物质在氧气中完全燃烧放出热量31.2kJ,写出热化学方程式_______。
(4)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用①和⑥组成的化合物和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式_______。
(5)元素②的单质在一定条件下,能与①的单质化合生成一种化合物,熔点为800℃。该化合物能与水反应放氢气,假设将1mol该化合物和1mol③形成的单质混合加入足量的水,充分反应后生成气体的体积是(标准状况下)_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】手持技术的氧电化学传感器可用于测定 O2含量,右图为某种氧电化学传感器的 原理示意图。已知在测定O2含量过程 中,电解质溶液的质量保持不变。一定时 间内,若通过传感器的待测气体为aL(标 准状况),某电极增重了b g。下列说法正确的是
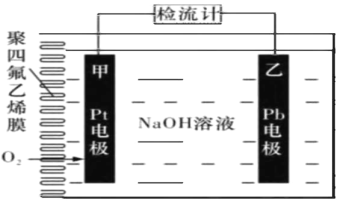
A.Pt电极为负极
B.反应过程中转移OH-的物质的量为0.125bmol
C.Pb电极上发生的电极反应为Pb-2e- +2OH- = Pb(OH)2
D.待测气体屮氧气的体积分数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】强酸性溶液X中可能含有Na+ , K+、NH4+、 Fe3+、Fe2+、Al3+、CO32-、 SO32-、SO42-、C1-的若干种,某同学为了确认其成分,取X溶液进行连 续实验,实验过程及产物如下所示:
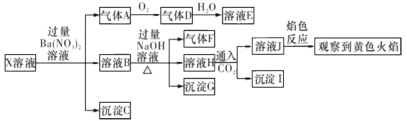
下列结论止确的是
A.气体A是SO2,证明原溶液中含有SO32-
B.沉淀G中加人盐酸溶解,滴加KSCN溶液显红色,可以确定原溶液中 有Fe3+
C.沉淀I―定是A1(OH)3
D.X中不能确定的离子是Al3+、Fe3+ 、Na+ 、K +和Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A.25℃,1 LpH=13的NaOH溶液中含有OH-的数目为0.1NA
B.标准状况下,4.6 g NO2和N2O4混合物中含氧原子数为0.3NA
C.标准状况下,6.72 L Cl2与水充分反应,转移电子数为0.3NA
D.0.1 mol/L NaHCO3溶液中,HCO3-、H2CO3和CO32-总数为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com