
(Ⅰ)2SO2(g)+O2(g)  2SO3(g)反应过程的能量变化如图所示。请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。请回答下列问题:
(1)图中A表示 。
(2)E的大小对该反应的焓变有无影响? 。
该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? 。
(3)某温度下,向1L密闭容器中开始充入2molSO2和1molO2,在V2O5催化剂存在时反应达到平衡,压强减小为开始时的 ;如在相同温度下,在同等体积的密闭容器中充入2mol的SO3,也在V2O5催化剂存在时反应达到平衡,求此温度下反应2SO3 (g)
;如在相同温度下,在同等体积的密闭容器中充入2mol的SO3,也在V2O5催化剂存在时反应达到平衡,求此温度下反应2SO3 (g)  2SO2(g) + O2(g)的平衡常数(写出计算过程)
2SO2(g) + O2(g)的平衡常数(写出计算过程)
(Ⅱ)化学试剂的生产和电镀工业排放的废水中常含有20~100mg.L-1Cr(Ⅵ),饮用含Cr(Ⅵ)的水会损害人的肠胃等,已知Cr(Ⅲ)的毒性是Cr(Ⅵ)的0.5%,国家规定工业废水含Cr(Ⅵ)的量排放标准为0.1mg.L-1。工业上常用化学法和电解法处理含Cr(Ⅵ)废水,再将Cr(Ⅲ)转化成沉淀除去,某研究性学习小组为研究废水的净化,设计了如下实验流程:
(1)配平第①步反应的离子方程式:
(2)第②步中用PH试纸测定溶液PH的操作是:
(3)设计一个电解装置也可以实现上述目的,装置如下图(用铁棒和石墨作电极):
电极材料:c为:
电极反应:d极:
Ⅰ. (1)反应物总能量 (1分)
(2)无 降低 (2分)
(3)设平衡时反应生成SO3的物质的量为2x mol
2SO2(g) + O2(g)  2SO3(g)
2SO3(g)
开始量 2mol 1mol 0
反应转化量 2x mol x mol 2x mol
平衡量 (2-2x)mol (1-x)mol 2x mol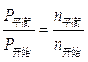
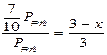 解得x="0.9" mol (2分)
解得x="0.9" mol (2分)
同等条件下开始加入2molSO3与开始加入2molSO2、1molO2是相当的,属于等效平衡,平衡时各物质的浓度相等。
反应2SO3 (g)  2SO2 (g) + O2(g) 的平衡常数:
2SO2 (g) + O2(g) 的平衡常数: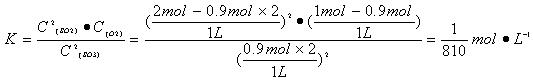
或1.2×10-3mol?L-1) (3分)
Ⅱ: (1) 1 6 14 2 6 7 H2O (2分)
(2)将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照,确定PH值。(2分)
(3)铁棒 2H+ + 2e - = H2↑ 或2H2O + 2e - = H2↑+2OH- (3分)
解析


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
A.0.4 mol B.0.6 mol C.0.8 mol D.1.2 mol
查看答案和解析>>
科目:高中化学 来源:2013届浙江省高二下学期第一次质检化学试卷(解析版) 题型:选择题
恒温恒容条件下,下列叙述正确的是
A.相同的甲、乙两容器中分别加入1 g SO2、1 g O2与2 g SO2、2 g O2,发生反应2SO2(g)+O2(g)  SO3(g)达到平衡,SO2的转化率前者大
SO3(g)达到平衡,SO2的转化率前者大
B.反应2HI(g)  H2(g)+I2(g)达到平衡,增大HI的物质的量,平衡不移动
H2(g)+I2(g)达到平衡,增大HI的物质的量,平衡不移动
C.反应2NO2(g )  N2O4(g)达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡时,与第一次平衡时相比,NO2的体积分数增大
N2O4(g)达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡时,与第一次平衡时相比,NO2的体积分数增大
D.反应2HI(g)  H2(g)+I2(g)达到平衡,增大HI的物质的量,HI的分解率和体积分数均不变
H2(g)+I2(g)达到平衡,增大HI的物质的量,HI的分解率和体积分数均不变
查看答案和解析>>
科目:高中化学 来源:2012届安徽省高二下学期期末联考化学试卷 题型:选择题
在容积不变的密闭容器中进行反应:2SO2(g)+O2(g) 2SO3(g);ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是
2SO3(g);ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是
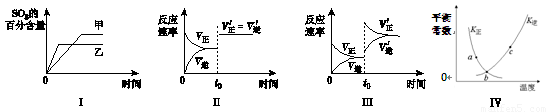
A.图Ⅰ表示温度对化学平衡的影响,且甲的温度较高
B.图Ⅱ表示t0时刻使用催化剂对反应速率的影响
C.图Ⅲ表示t0时刻增大O2的浓度对反应速率的影响
D.图Ⅳ中a、b、c三点中只有b点已经达到化学平衡状态.
查看答案和解析>>
科目:高中化学 来源:09-10学年衡中高二下学期第二次调研考试化学试卷 题型:选择题
下列说法或表示方法正确的是( )
A.反应物的总能量低于生成物的总能量时,该反应一定不能发生
B.化学键和分子间作用力都对物质的性质有一定的影响
 C.已知:2SO2 (g) + O2
(g) 2SO3 (g) ;△H = -98.3
kJ/mol。将1 mol SO2和0.5 mol O2充入一密闭容器中反应,放出49.15 kJ 的热量
C.已知:2SO2 (g) + O2
(g) 2SO3 (g) ;△H = -98.3
kJ/mol。将1 mol SO2和0.5 mol O2充入一密闭容器中反应,放出49.15 kJ 的热量
D.由石墨比金刚石稳定可知:C(金刚石,s)= C(石墨,s) ;△H<0
查看答案和解析>>
科目:高中化学 来源:09-10学年长春外国语学校高一下学期第二次月考理科化学卷 题型:选择题
对于反应2SO2(g)+O2(g) 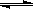 2SO3(g)能增大正反应速率的措施是
2SO3(g)能增大正反应速率的措施是
A.通入大量O2 B.增大容器容积
C.移去部分SO3 D.降低体系温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com